
| 实验要求 | 选用的试剂 | 涉及的离子方程式 |
| 除去氢氧化镁中的氢氧化铝杂质 | ||
| 除去FeCl2溶液中FeCl3 | ||
| 鉴别炭粉和氧化铜 |
| 实验要求 | 选用的试剂 | 涉及的离子方程式 |
| 除去氢氧化镁中的氢氧化铝杂质 | NaOH溶液 | Al(OH)3+OH-=AlO2-+2H2O |
| 除去FeCl2溶液中FeCl3 | Fe | 2Fe3++Fe=3Fe2+ |
| 鉴别炭粉和氧化铜 | 盐酸 | CuO+2H+=Cu2++H2O |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
 纽约一家公司设计出Soccket足球,每被踢一下,足球的内置机制就会把能量储存起来;被储存的能量可以通过USB接口给手机或其他小家电充电.在Soccket足球充放电的过程中,能量转化的主要形式是( )
纽约一家公司设计出Soccket足球,每被踢一下,足球的内置机制就会把能量储存起来;被储存的能量可以通过USB接口给手机或其他小家电充电.在Soccket足球充放电的过程中,能量转化的主要形式是( )| A、电能→化学能→电能 |
| B、化学能→电能→化学能 |
| C、机械能→电能→化学能 |
| D、机械能→化学能→电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2HI(g)=H2(g)+I2(g);△H=+11 kJ?mol-1 |
| B、H2(g)+I2(g)=HI(g);△H=-11 kJ?mol-1 |
| C、H2(g)+I2(g)=2HI(g);△H=+288 kJ?mol-1 |
| D、H2(g)+I2(g)=HI(g);△H=-114 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
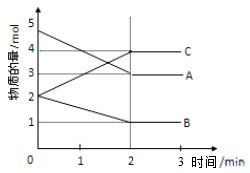 某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:
某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.写出FeCl3溶液腐蚀印刷电路铜板的离子方程式| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na与水反应时增大水的用量 | |||
| B、Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |||
| C、在H2SO4与Na2CO3两溶液反应时,增大压强 | |||
D、反应N2+3H2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁片放入稀盐酸中:Fe+2H+=Fe3++H2↑ |
| B、氢氧化铜与稀硫酸:OH-+H+=H2O |
| C、氯化钡溶液与硝酸银溶液:Cl-+Ag+=AgCl↓ |
| D、碳酸钙与稀硝酸:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com