
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价电子排布式为_________________。
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
①C2F4分子中所含共价键的类型有_____,C2F4分子中碳原子的杂化轨道类型是____,聚四氟乙烯是一种准晶体,证明它不是晶体可用的实验方法是_______________。
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因_______________。
③与NO2F分子互为等电子的非极性分子有__________(写一个符合要求的化学式即可)。
(3)CaF2的晶体结构如图所示。
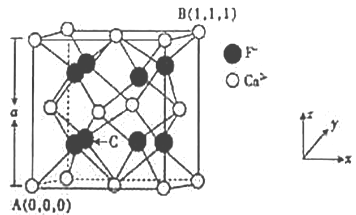
①CaF2晶胞中,Ca2+的配位数为_____;F-的配位数为_____。
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为______________。
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为_____(列出计算式即可)g/cm3。
【答案】 2s22p5 σ键,π键 sp2 X射线衔射 BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键 BF3(或BCl3、SO3等) 8 4 ![]()
![]()
【解析】(1)F为9号元素,基态氟原子的价电子排布式为2s22p5,故答案为:2s22p5;
(2)①C2F4分子的结构类似于乙烯,所含共价键的类型有C-F间的σ键和C=C中的σ键和π键;C2F4分子为平面形状,碳原子的杂化轨道类型为sp2,聚四氟乙烯是一种准晶体,可以通过X射线衍射实验证明它不是晶体,故答案为:σ键,π键;sp2;X射线衍射;
②BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键,因此HF与BF3化合可得到HBF4,故答案为:BF3中硼原子有空轨道,HF中氟原子有孤对电子,两者之间可形成配位键;
③与NO2F分子互为等电子的非极性分子有BF3(或BCl3、SO3等),故答案为:BF3(或BCl3、SO3等);
(3)①根据CaF2晶胞结构,每个F-周围有4个距离相等且最近的Ca2+,这4个钙离子构成正四面体结构,F-的配位数为4,在CaF2晶胞中Ca2+与F-的个数比为1:2,则Ca2+的配位数为8,故答案为:8;4;
②根据CaF2的晶体结构,氟离子分布在晶胞内,A、B原子的坐标参数依次为(0,0,0)、 (1,1,1),氟离子分布在晶胞内,8个氟离子构成立方体结构,每侧的4个负离子所在平面距离最近的晶胞的侧面为晶胞边长的![]() ,因此C点的原子坐标参数为(
,因此C点的原子坐标参数为(![]() ,
, ![]() ,
, ![]() ),故答案为:(
),故答案为:(![]() ,
, ![]() ,
, ![]() );
);
③根据CaF2晶胞结构,晶胞中含有8个氟离子,则含有4个钙离子,晶胞参数A=546.2pm,则其密度为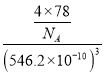 g/cm3=
g/cm3=![]() g/cm3=
g/cm3=![]() g/cm3,故答案为:
g/cm3,故答案为: ![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向MgCl2溶液中滴加过量氨水:Mg2++2OH-=Mg(OH)2↓
B. 用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO![]() =Ag++NO↑+2H2O
=Ag++NO↑+2H2O
C. 将Cu粉加入到Fe2(SO4)3溶液中:2Fe3++3Cu=2Fe+3Cu2+
D. 向NaAlO2溶液中通入过量CO2:AlO![]() +CO2+2H2O=Al(OH)3↓+HCO
+CO2+2H2O=Al(OH)3↓+HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法合理的是( )
A. Si可用于制造太阳能电池
B. 液氨可用作制冷剂
C. 聚氯乙烯可用于制食品包装袋
D. 漂白粉可用于杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):

3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
②废气中的CO2转化为甲醇可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。该燃料电池中通入甲醇的一极为____(填a或b),当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。

(2)H2还原法可消除氮氧化物
已知: N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8kJ·mol-1
①在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为_____________。
② 以H2(g)为燃料可以设计氢气燃料电池,该电池以稀NaOH作电解质溶液,其负极电极反应式为___________________________________________________________,已知该电池的能量转换效率为86.4%,则该电池的比能量为________kW·h·kg-1(结果保留1位小数,比能量=![]() ,1 kW·h=3.6×106 J) 。
,1 kW·h=3.6×106 J) 。
(3)微生物燃料电池(MFC)是一种现代化的氨氮去除技术。下图为MFC碳氮联合同时去除的示意图。

①已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式____________________________________________。
②解释该装置去除NH4+的原理_______________________________________________。
(4)利用“ Na—CO2”电池可将CO2变废为宝。

我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料(反应前两电极质量相等),总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为______________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
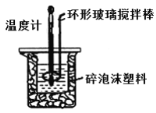
【题目】某同学用50 mL 0.50mol·L-l盐酸与50 mL 0.55 mol·L-1NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量并计算中和热,回答下列问题:
(1)该实验小组做了三次实验,每次取溶液各50 mL,并将实验数据记录如下:
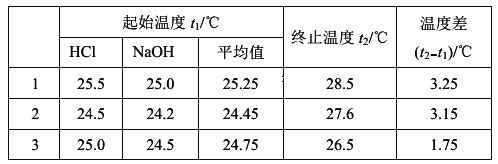
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4. 2×10-3kJ/(g·℃),则该反应的中和热△H=__________。
(2)若用50 mL 0.55 mol·L-1的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会____(填“偏小”、“偏大”或“不变”),其原因是___________________________________。
(3)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_____________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应中能量变化的说法正确的是
A.断开化学键会释放能量B.氧化还原反应均为放热反应
C.化学反应过程中一定伴有能量变化D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有甲、乙两份体积均为1L、浓度均为0.1mol·L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释到100L时,溶液的pH变为x;②乙与等体积、浓度为0.2mol·L-1的NaOH溶液混合,在混合液中:n(CH3COO-)+n(OH-)-(H+)=y mol。x、y的正确答案组合为
A. 3<x<5、0.2 B. 3<x<5、0.1 C. 3、0.1 D. 5、0.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃、101kPa时,一些物质的燃烧热为,回答下列问题:
化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
△H/(kJ·mol-l) | -283.0 | -285.8 | -726.5 | -890.3 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:_____________________________。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)![]() CH3OH(l)△H=__________。
CH3OH(l)△H=__________。
(3)工业上利用水煤气合成甲醇的主要反应可表示为![]() CO(g)+H2(g)
CO(g)+H2(g)![]()
![]() CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①相同温度条件下,上述反应的化学平衡常数K=___________。
②若容器容积不变,下列措施可增加CH3OH产率的是___________ (填标号)。
a.升高温度
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.再充入0.10molH2和0.05molCO
e.加入催化剂
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将___________(填“逆向”“正向”或“不”)移动,化学平衡常数K___________(填“增大”“减小”或“不变”)。
④温度、容积相同的甲、乙两个密闭容器,若甲中加入1molCO和2molH2,乙中加入lmolCH3OH(g),反应达到平衡时甲放出的热量为Q1kJ,乙吸收的热量为Q2kJ,甲中CO的转化率为a1,乙中CH3OH的转化率为a2,则Q1+Q2=___________,a1+a2=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S ![]() SO3
SO3 ![]() H2SO4
H2SO4
③饱和NaCl(aq)![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④Fe2O3 ![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A. ②③④ B. ①③⑤ C. ②④⑤ D. ①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com