

| A.甲池b极上析出金属银,乙池c极上析出某金属 |
| B.甲池a极上析出金属银,乙池d极上析出某金属 |
| C.某盐溶液可能是CuSO4溶液 |
| D.某盐溶液可能是Mg(NO3)2溶液 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:单选题
| A.电解过程中的阳极反应为:[Fe(CN)6]2――e-=[Fe(CN)6]3- |
| B.电解过程中阴极附近溶液的pH降低 |
| C.电解过程中每处理l mol硫化氢气体,理论上转移电子2 mol |
| D.该处理方法理论上不需要补充电解质溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
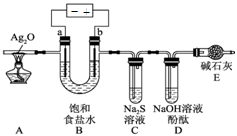
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
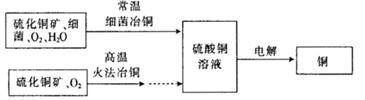
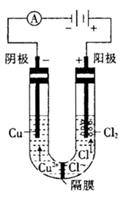
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
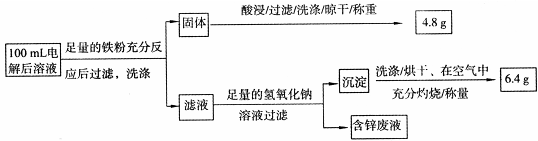
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解时,石墨作阴极,铁作阳极 |
| B.电解时,在阴极上产生KIO3 |
| C.电解后电解质溶液pH变大 |
| D.电解中每转移0.6mol e-,理论上可得到0.1mol无水KIO3晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
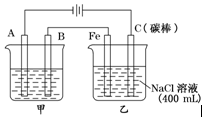
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuSO4 | B.Cu(OH)2 | C.Cu | D.CuO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cd + 2NiO(OH)+ 2H2O
Cd + 2NiO(OH)+ 2H2O | A.Cd | B.NiO(OH) | C.Cd(OH)2 | D.Ni(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com