
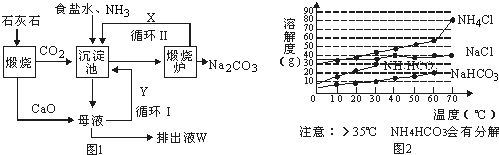
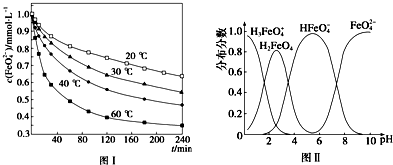
·ÖĪö £Ø1£©ÓÉŃĒĻõĖįÄĘÄÜŹ¹ŃŖŗģµ°°×ÖŠFe2+×Ŗ»ÆĪŖøßĢśŃŖŗģµ°°×¶ųŹ¹ČĖ·¢Éś¼±ŠŌÖŠ¶¾£¬ŌņŃĒĻõĖįÄĘ¾ßÓŠŃõ»ÆŠŌ£¬ŌŁÓÉ·žÓĆĪ¬ÉśĖŲCæɽā³żNaNO2ŃĪÖŠ¶¾£¬Ōņ½ā¶¾¹ż³ĢÖŠFeŌŖĖŲµÄ»ÆŗĻ¼Ū½µµĶ£¬Ī¬ÉśĖŲC֊ijŌŖĖŲµÄ»ÆŗĻ¼ŪÉżøߣ¬ĪóŹ³ŃĒĻõĖįÄĘÖŠ¶¾£¬æÉ·žĪ¬ÉśĖŲC»ŗ½ā£¬ĖµĆ÷Ī¬ÉśĖŲC¾ßÓŠ»¹ŌŠŌ£¬ŅŌ“ĖĄ“½ā“š£»
£Ø2£©6CeO2+18NH4FØT6CeF3+16NH3”ü+12H2O+N2”ü·“Ó¦ÖŠCe µÄ»ÆŗĻ¼Ū“Ó+4¼Ū½µµĶµ½+3¼Ū£¬NŌŖĖŲµÄ»ÆŗĻ¼Ū“Ó-3¼ŪÉżøßµ½0¼Ū£¬øł¾Żµē×ÓŹŲŗć¼ĘĖć£®
½ā“š ½ā£ŗŃĒĻõĖįÄĘÄÜŹ¹ŃŖŗģµ°°×ÖŠFe2+×Ŗ»ÆĪŖøßĢśŃŖŗģµ°°×¶ųŹ¹ČĖ·¢Éś¼±ŠŌÖŠ¶¾£¬ŌņŃĒĻõĖįÄĘ¾ßÓŠŃõ»ÆŠŌ£¬ŹĒŃõ»Æ¼Į£¬Fe2+±»Ńõ»Æ£¬ĪóŹ³ŃĒĻõĖįÄĘÖŠ¶¾£¬æÉ·žĪ¬ÉśĖŲC»ŗ½ā£¬ĖµĆ÷Ī¬ÉśĖŲC¾ßÓŠ»¹ŌŠŌ£¬
¹Ź“š°øĪŖ£ŗŃõ»Æ£»Ńõ»Æ£»»¹Ō£»
£Ø2£©6CeO2+18NH4FØT6CeF3+16NH3”ü+12H2O+N2”ü·“Ó¦ÖŠCe µÄ»ÆŗĻ¼Ū“Ó+4¼Ū½µµĶµ½+3¼Ū£¬ŌņCeO2ĪŖŃõ»Æ¼Į£¬NŌŖĖŲµÄ»ÆŗĻ¼Ū“Ó-3¼ŪÉżøßµ½0¼Ū£¬ŌņNH4FĪŖ»¹Ō¼Į£¬·“Ó¦ÖŠ18molNŌ×Ó²Ī¼Ó·“Ó¦£¬Ö»ÓŠ2molNŌ×Ó±»Ńõ»Æ£¬ĖłŅŌ·“Ó¦ÖŠ±»Ńõ»ÆµÄµŖŌ×ÓÓėĪ“±»Ńõ»ÆµÄµŖŌ×ÓĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ16=1£ŗ8£»
¹Ź“š°øĪŖ£ŗCeO2£»NH4F£»1£ŗ8£®
µćĘĄ ±¾ĢāŅŌŠÅĻ¢µÄŠĪŹ½æ¼²éŃõ»Æ»¹Ō·“Ó¦£¬°ŃĪÕ·“Ó¦ÖŠŌŖĖŲµÄ»ÆŗĻ¼Ū±ä»ÆĪŖ½ā“šµÄ¹Ų¼ü£¬×¢ŅāĻ°ĢāÖŠŠÅĻ¢µÄÓ¦ÓĆ£¬²ąÖŲŃõ»Æ»¹Ō·“Ó¦ÖŠ»ł±¾øÅÄīµÄ漲飬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1molFeČÜÓŚ¹żĮæĻõĖį£¬µē×Ó×ŖŅĘŹżĪŖ2NA | |
| B£® | 1molN2Óė4molH2·“Ӧɜ³ÉµÄNH3·Ö×ÓŹżĪŖ2NA | |
| C£® | ±ź×¼×“æöĻĀ£¬2.24LCCl4ŗ¬ÓŠµÄ¹²¼Ū¼üŹżĪŖ0.4NA | |
| D£® | 14gŅŅĻ©ŗĶ±ūĻ©»ģŗĻĘųĢåÖŠµÄĒāŌ×ÓŹżĪŖ2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
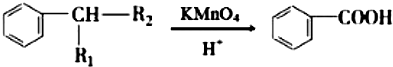 £ØR1”¢R2±ķŹ¾Ģž»ł»ņĒāŌ×Ó£©
£ØR1”¢R2±ķŹ¾Ģž»ł»ņĒāŌ×Ó£©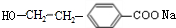 £®
£®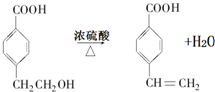 £®
£®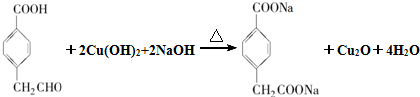 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 °“ŅŖĒóĢīæÕ£ŗ
°“ŅŖĒóĢīæÕ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ū¢Ü¢Ż | B£® | ¢Ś¢Ū¢Ü¢Ż¢Ž | C£® | ¢Ś¢Ū¢Ż¢Ž¢ß | D£® | ¢Ł¢Ś¢Ż¢Ž¢ß |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
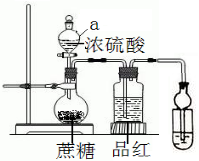 ŌŚÉÕĘæ·Å20æĖÕįĢĒ£¬ŅĄ“Ī¼ÓČėÉŁĮæĖ®”¢20mLÅØĮņĖį£¬ÕįĢĒÖš½„±äŗŚ£¬Ģå»żÅņÕĶ£¬ŠĪ³ÉŹčĖɶąæ×µÄŗŚĆę°ü£¬ÉÕĘæ·¢ĢĢ£¬Ę·ŗģČÜŅŗŃÕÉ«±äµ£®Ēė»Ų“š£ŗ
ŌŚÉÕĘæ·Å20æĖÕįĢĒ£¬ŅĄ“Ī¼ÓČėÉŁĮæĖ®”¢20mLÅØĮņĖį£¬ÕįĢĒÖš½„±äŗŚ£¬Ģå»żÅņÕĶ£¬ŠĪ³ÉŹčĖɶąæ×µÄŗŚĆę°ü£¬ÉÕĘæ·¢ĢĢ£¬Ę·ŗģČÜŅŗŃÕÉ«±äµ£®Ēė»Ų“š£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ³£ĪĀĻĀ0.4 mol/L HBČÜŅŗŗĶ 0.2 mol/L NaOHČÜŅŗµČĢå»ż»ģŗĻŗóČÜŅŗµÄpH=3£¬Ōņ»ģŗĻČÜŅŗÖŠĄė×ÓÅØ¶ČµÄ“óŠ”Ė³ŠņĪŖ£ŗc£ØB-£©£¾c£ØH+£©£¾c£ØNa+£©£¾c£ØOH-£© | |
| B£® | µČÅØ¶ČµÄĻĀĮŠĻ”ČÜŅŗ£ŗ¢ŁĮņĖįĒāÄĘ ¢ŚŅŅĖįÄĘ ¢Ū“×Ėį ¢ÜĢ¼ĖįĒāÄĘ ¢ŻĻõĖįÄĘ ¢Ž±½·ÓÄĘ£¬ĖüĆĒµÄpHÓÉŠ”µ½“óÅÅĮŠĪŖ£ŗ¢Ū¢Ż¢Ł¢Ü¢Ś¢Ž | |
| C£® | ³£ĪĀĻĀ0.1 mol/LµÄĻĀĮŠČÜŅŗ ¢ŁNH4Al£ØSO4£©2 ¢ŚNH4Cl ¢ŪNH3•H2O ¢ÜCH3COONH4ÖŠc £ØNH4+£©Óɓ󵽊”µÄĖ³ŠņŹĒ£ŗ¢Ś£¾¢Ł£¾¢Ü£¾¢Ū | |
| D£® | ŌŚ25”ꏱ£¬½«a mol•L-1µÄ°±Ė®Óė0.01 mol•L-1µÄŃĪĖįµČĢå»ż»ģŗĻ·“Ó¦Ź±ČÜŅŗÖŠc£ØNH4+£©=c£ØCl-£©£®ÓĆŗ¬aµÄ“śŹżŹ½±ķŹ¾NH3•H2OµÄµēĄė³£ŹżKb=$\frac{1{0}^{-9}}{a-0.01}$ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com