
| A. | 向溶液中加水稀释至10 L | B. | 加入一定量的NaOH固体 | ||
| C. | 加入一定量pH=8的NaOH溶液 | D. | 加入一定浓度的盐酸 |
分析 A.由pH=5增大3得pH=8,说明溶液呈碱性;
B.加入一定量的NaOH固体,可以使溶液显碱性;
C.因加入NaOH溶液的pH=8,混合后pH一定小于8;
D.加盐酸,溶液一定显酸性.
解答 解:A.由pH=5增大3得pH=8,说明溶液呈碱性,酸溶液无论如何稀释溶液也不会呈碱性,故A错误;
B.加入一定量的NaOH固体,可以使溶液显碱性,即pH=5的CH3COOH溶液10mL,加适量的NaOH固体可以使溶液的pH变为8,故B正确;
C.因加入NaOH溶液的pH=8,混合后pH一定小于8,所以不能使pH=5的CH3COOH溶液的pH增大3,故C错误;
D.由pH=5增大3得pH=8,说明溶液呈碱性,加盐酸,溶液一定显酸性,故D错误.
故选B.
点评 本题考查了溶液的pH的变化,题目难度不大,注意把握题中关键词,pH=5增大3得pH=8,溶液呈碱性,要加碱.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Pt电极电解少量的MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 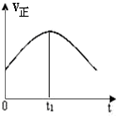 | B. | 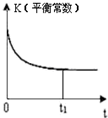 | C. | 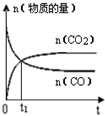 | D. | 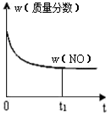 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
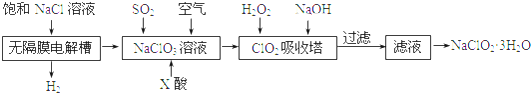
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
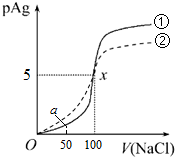
| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | Kφ(AgCl)=1×10-10 | |
| C. | a点时,溶液中c(Cl-)=1.2×10-9mol•L-1 | |
| D. | 若把0.1mol•L-1的NaCl溶液换成0.1mol•L-1的NaI溶液,则pAg的变化图象变成曲线② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
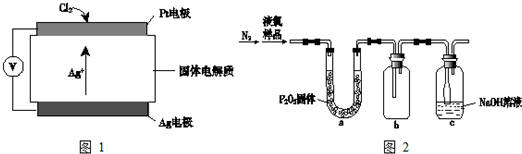
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgI比AgCl更难溶于水,所以AgCl易转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| D. | AgCl不溶于水,不能转化为AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、NO2均为酸性氧化物 | |
| B. | 稀豆浆、鸡蛋清溶液、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、甲苯均为电解质 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com