
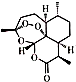
 .关于它的说法中,正确的是( )
.关于它的说法中,正确的是( )| A. | 青蒿素是一种氧化物 | |
| B. | 青蒿素中氧元素的质量分数为11.9% | |
| C. | 青蒿素中C、H、O三种元素的质量比为90:11:40 | |
| D. | 青蒿素是由15个碳原子、22个氢原子和5个氧原子构成的 |
分析 A.根据氧化物的特点考虑;
B.根据氧元素质量分数计算;
C.根据分子式计算;
D.根据结构简式判断分子式,可确定原子个数的比值.
解答 解:A、根据氧化物的概念可知氧化物只有两种元素,且必须有氧元素.该物质由三种元素组成,故A错误;
B、青蒿素中氧元素的质量分数为:$\frac{16×5}{12×15+1×22+16×5}$×100%=28.4%,故B错误;
C、青蒿素中C、H、0三种元素的质量比为12×15:1×22:16×5=90:11:40,故C正确;
D、青蒿素属于物质属于宏观概念可以用元素解释:青蒿素是由碳、氢、氧三种元素组成,故D错误.
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,注意把握有机物的组成,难度不大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA | |
| C. | 25℃时,pH=2的硫酸溶液中,含有的H+的数目为0.01NA | |
| D. | 5.6 g Fe与一定量稀硝酸反应,Fe完全溶解时失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液中:Mg2+、Al3+、NO3-、ClO- | |
| B. | 与Al反应能放H2的溶液中:Na+、Cu2+、NO3-、I- | |
| C. | 0.1 mol•L-1Na2CO3溶液中:NH4+、K+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液中:Ca2+、Na+、SiO32-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥⑦ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示): .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )| A. | 分子式为C9H10NO2 | |
| B. | 苯环上有2个取代基,且含有硝基的同分异构体有6种 | |
| C. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| D. | 分子中含有3种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多的 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com