
【题目】胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法,其中正确的是( ) 
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2mol Br2发生反应.
A.①③
B.①②④
C.②③
D.②③④
科目:高中化学 来源: 题型:
【题目】工业生产中容易产生有害的含铬工业废水和含氰废水,严重威胁人类的健康和安全.图1是处理工业含铬废水和含氰废水的工艺流程. 
已知:含铬废水中铬的存在形式为Cr2O72﹣ , Cr元素常见的化合价+3、+6,含氰废水中有CN﹣存在.
请回答下列问题:
(1)含氰废水中有CN﹣存在,其中C元素的化合价为 .
的代数式表示)
(2)向含铬废水中加下列哪种物质将pH调整到2~3,(填字母).
a.稀盐酸 b.稀硫酸 c.稀硝酸
的代数式表示)
(3)pH>10时,图中反应Ⅱ中的NaClO可以将CN﹣氧化为两种无毒物质,请写出反应的离子方程式 .
的代数式表示)
(4)经过图中反应Ⅰ和图中反应Ⅱ后,将两种废水混合的目的是
的代数式表示)
(5)工业上也常用电解法处理酸性含铬废水,用耐酸电解槽,铁板作电极,槽中盛放酸性含Cr2O72﹣的废水,原理示意图如图2: 
阳极区域溶液中发生反应的离子方程式为 . 若不考虑气体的溶解,当收集到H2 13.44L(标准状况)时,被还原的Cr2O72﹣物质的量为 . 为了使Cr3+和Fe3+转化为Fe (OH)3和Cr(OH)3沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中c(Fe3+)=2.0×10﹣12 molL﹣1 , 则溶液中c (Cr3+)=molL﹣1 . (已知:Ksp[Fe (OH)3]=4.0×10﹣38 , Ksp[Cr(OH)3]=6.0×10﹣31)
的代数式表示)
(6)在25℃下,将a molL﹣1 NaCN溶液与0.01molL﹣1盐酸等体积混合(忽略溶液体积变化),反应后测得溶液pH=7,HCN的电离常数Ka为 . (用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②太阳能 ③风能 ④石油 ⑤煤 ⑥生物质能 ⑦氢能
A. ①②③④B. ②③⑥⑦C. ①②⑤⑥⑦D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物对化工生产有重要意义.
(1)工业合成氨的原理为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 .
下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为n)对该平衡的影响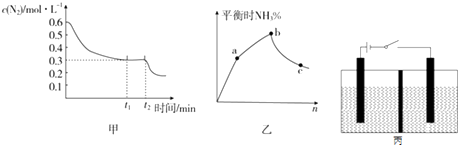
①已知图甲中0~t1 min内,v(H2)=0.03molL﹣1min﹣1 , 则t1=;若从t2 min起仅改变一个反应条件,则所改变的条件可能是(填一种即可);图乙中,b点时n= .
②已知某温度下该反应的K=10,该温度下向容器中同时加入下列浓度的混合气体:c(H2)=0.1molL﹣1 , c(N2)=0.5molL﹣1 , c(NH3)=0.1molL﹣1 , 则在平衡建立过程中NH3的浓度变化趋势是(填“逐渐增大”“逐渐减小”或“恒定不变”).
(2)已知肼(N2H4)是二元弱碱,其电离是分步的,电离方程式为、 .
(3)中国航天科技集团公司计划在2015年完成20次宇航发射任务.肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)═N2O4(l)
△H1=﹣195kJmol﹣1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)
△H2=﹣534.2kJmol﹣1
写出肼和N2O4反应的热化学方程式: .
(4)以NO2为原料可以制得新型绿色硝化剂N2O5 , 原理是先将NO2转化为N2O4 , 然后采用电解法制备N2O5 , 其装置如图丙所示,两端是石墨电极,中间隔板只允许离子通过,不允许水分子通过.
①已知两室加入的试剂分别是:a.硝酸溶液;b.N2O4和无水硝酸,则左室加入的试剂应为(填代号),其电极反应式为 .
②若以甲醇燃料电池为电源进行上述电解,已知:CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(g)△H=﹣651kJmol﹣1 , 又知甲醇和水的汽化热分别为11kJmol﹣1、44kJmol﹣1 , 标准状况下,该燃料电池消耗0.5mol CH3OH产生的最大电能为345.8kJ,则该电池的能量效率为(电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比).
O2(g)═CO2(g)+2H2O(g)△H=﹣651kJmol﹣1 , 又知甲醇和水的汽化热分别为11kJmol﹣1、44kJmol﹣1 , 标准状况下,该燃料电池消耗0.5mol CH3OH产生的最大电能为345.8kJ,则该电池的能量效率为(电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的离子方程式正确的是( )
A.硫酸亚铁在空气中被氧化:4Fe2++3O2+6H2O═4Fe(OH)3
B.向CH2Br﹣COOH中加入足量的NaOH溶液并加热:CH2Br﹣COOH+OH﹣ ![]() CH2Br﹣COO﹣+H2O
CH2Br﹣COO﹣+H2O
C.FeCl3溶液中通入SO2 , 溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42﹣+4H+
D.碳酸钠溶液滴入酚酞变红:CO32﹣+2H2O?H2CO3+2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“甲型H1N1”流感疫情已构成“具有国际影响的公共卫生紧急事态”.已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示.下列说法正确的是( ) 
A.该物质的分子式为C12H20N4O7
B.1mol该物质与NaOH溶液反应,可以消耗4molNaOH
C.在一定条件下,该物质可以发生消去、加成、取代等反应
D.该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氯化铁易潮解.如图是制取无水氯化铁的实验装置图,将分液漏斗中的浓盐酸加入到盛有二氧化锰的烧瓶中,请回答下列问题: 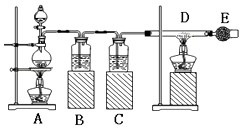
(1)烧瓶中发生反应的化学方程式是;
(2)B瓶中的溶液是;C瓶中的溶液是 .
(3)玻璃管D中发生反应的化学方程式为 .
(4)干燥管E中盛有碱石灰,其作用是(回答一点即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,Q,T的原子序数与其常见化合价关系如图.下列说法正确的是( ) 
A.1 mol TX2与足量X2反应生成TX3的分子数目为NA
B.Z元素形成的可溶性盐溶液可能显碱性
C.1 mol Y2X2与足量H2O反应转移的电子数目为2NA
D.0.1 molQ元素的含氧酸在水中电离出的H十数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2﹣氯丙烷制取少量的1,2﹣丙二醇 ![]() 时,需要经过下列哪几步反应( )
时,需要经过下列哪几步反应( )
A.消去、加成、取代
B.加成、消去、取代
C.取代、消去、加成
D.消去、加成、消去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com