
| A. | AlN中氮元素的化合价为+3 | |
| B. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| C. | 上述反应中,每生成1molAlN需转移6mol电子 | |
| D. | AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑ |
分析 Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO中,N元素化合价降低,N2为氧化剂,C元素化合价升高,C为还原剂,结合元素化合价的变化判断电子转移的数目.
解答 解:A、由化合价代数和为0可知,氮化铝中铝元素化合价为+3价,氮元素的化合价为-3,故A错误;
B、在氮化铝的合成反应中,N2是氧化剂,Al2O3既不是氧化剂,也不是还原剂,故B错误;
C、上述反应中N元素化合价由0价降低到-3价,每生成2mol AlN,N2得到6mol电子,故C错误;
D、AlN与NaOH溶液反应,相当AlN先与水反应生成氢氧化铝和氨气,然后氢氧化铝与氢氧化钠反应生成偏铝酸钠,所以反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,故D正确;
故选D.
点评 本题考查氧化还原反应,题目难度不大,注意把握元素化合价的判断,从化合价变化的角度分析,题目侧重于相关概念的考查.


科目:高中化学 来源: 题型:选择题
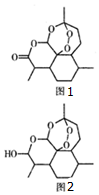 2011年9月12日,中国科学家屠呦呦获拉斯克一狄贝基临床医学研究奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低温条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构筒式如图1所示.下列有关青蒿素的说法错误的是( )
2011年9月12日,中国科学家屠呦呦获拉斯克一狄贝基临床医学研究奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低温条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构筒式如图1所示.下列有关青蒿素的说法错误的是( )| A. | 青蒿素耐高温且易溶于水不易溶于乙醚、乙酸乙酯等有机溶剂 | |
| B. | 青蒿素分子内的1个过氧基团是对付疟原虫的核心基团 | |
| C. | 1mol青蒿素分子在碱性条件下彻底水解需消耗1mol分子水 | |
| D. | 药效比青蒿素高10倍的双氢青蒿素(见图2)化学式为C15H24O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
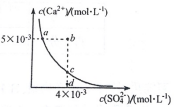 常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )| A. | b 点可能有沉淀生成 | |
| B. | a 点对应的Ksp 等于c 点对应的Ksp | |
| C. | 在d 点溶液中加入一定量的CaCl2可能会有沉淀析出 | |
| D. | CaSO4 溶解在水中,一定有c(Ca2+)=c(SO42-)=3×10-3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 | |
| B. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 0.1molNa2O2与足量二氧化碳充分反应转移的电子数为0.2NA | |
| D. | 0.1molFe在0.1mol氯气中燃烧,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分类 | 名称(或俗名) | 化学式 | |
| A | 碱性氧化物 | 铁红 | FeO |
| B | 碱性氧化物 | 刚玉 | Al2O3 |
| C | 酸 | 硫酸 | H2S |
| D | 盐 | 纯碱 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与Ba(OH)2溶液反应:H++OH-═H2O | |
| B. | 石灰石溶于盐酸中:CO32-+2H+═H2O+CO2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 氯化铝溶液与过量氨水反应:3NH3•H2O+Al3+═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨棒做电极电解氯化铜溶液,与负极相连的石墨棒上有气泡产生 | |
| B. | 氢氧燃料电池工作时氢气在负极被氧化 | |
| C. | 铅蓄电池充电时,PbSO4仅在负极生成 | |
| D. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层,这种变化属于原电池反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、H+、NO3-、Cl- | B. | H+、Na+、Cl-、CO32- | ||
| C. | Na+、Mg2+、OH-、SO42- | D. | K+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com