
一些酸在反应中可以表现出多种性质,如在反应Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 中:
(1)氧化剂是 ,氧化产物是 ,还原剂是 ,还原产物是 。
(2)在此反应中,浓硝酸表现出 性和 性。
(3)当生成标况下11.2 L NO2 时,反应中转移的电子数是_______mol.
科目:高中化学 来源:2016届安徽省庐江县六校高三上学期第四次联考化学试卷(解析版) 题型:实验题
工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝.工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)

(1)钢材镀铝后,抗腐蚀性能会大大增强,其原因是 .
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去.气泡的主要成分除Cl2外还含有 ,固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 .
(3)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 .
(4)向滤液中通入过量CO2所发生反应的离子方程式为 .
(5)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4﹣形式存在,则阳极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省、泥河中学高二上12月联考化学试卷(解析版) 题型:选择题
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr;△H﹤0,平衡时Br2(g)的转化率为a;若初使条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2HBr;△H﹤0,平衡时Br2(g)的转化率为a;若初使条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
A. 无法确定 B.a=b C.a﹤b D. a﹥b
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中(文)化学试卷(解析版) 题型:选择题
2022年北京-张家口第24届冬季奥林匹克运动会三大理念是“以运动员为中心、可持续发展、节俭办赛”,为了可持续发展,下列环保建议中,你认为不能采纳的是
A.用天然气代替汽油和柴油作发动机燃料
B.开发、使用新能源
C.禁止未经处理的工业废水和生活污水的任意排放
D.大量使用农药,提高粮食产量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列化学反应基本类型中一定发生电子转移的是 ( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上学期期中考试化学试卷(解析版) 题型:选择题
温度为T时;向2.0 L恒容密闭容器中充入1.0 mol PCl5;反应PCl5(g) 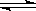 PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0. 19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B.保持其他条件不变;升高温度;平衡时c(PCl3)=0.11 mol·L-1;则反应的ΔH<0
C.相同温度下;起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2;反应达到平衡前v(正)>v(逆)
D.相同温度下;起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2;达到平衡时;PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列离子方程式改写成化学方程式正确的是
A.Cu2++2OH-=Cu(OH)2? CuCO3+2NaOH Cu(OH)2?+Na2CO3
Cu(OH)2?+Na2CO3
B.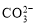 +2H+=CO2?+H2O BaCO3+2HCl
+2H+=CO2?+H2O BaCO3+2HCl BaCl2+CO2?+H2O
BaCl2+CO2?+H2O
C.Ba2++SO42-=BaSO4? Ba(OH)2+MgSO4 BaSO4?+Mg(OH)2?
BaSO4?+Mg(OH)2?
D.H++OH-=H2O 2KOH+H2SO4 K2SO4+2H2O
K2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列物质中,属于强电解质的是( )
A.H2O B.NaCl C.NH3·H2O D.CH3COOH
查看答案和解析>>
科目:高中化学 来源:2016届河南省开封市高三上学期第一次模拟理综化学试卷(解析版) 题型:填空题
[化学—选修2化学与技术]《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景。人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法。
(1)天然水在净化处理过程中加入明矾做混凝剂,其净水作用的原理是_________(用离子方程式表示)
(2)家庭用水可以用肥皂水检验其硬度,因为 。家用净水器中装有活性炭和阳离子交换树脂(NaR),用过的阳离子交换树脂放入 中可再生。
(3)电渗析法淡化海水的示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。

阳极的主要电极反应式是________。在阴极附近加入无色酚酞,看到的现象是___________________________。淡水的出口为________(填“a”“b”或“c”)。
(4)利用海水制得的食盐,制取纯碱的简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①滤出晶体C后,从滤液D中提取氯化铵有两种方法:
方法一、通入氨,冷却、加食盐,过滤;
方法二、不通氨,冷却、加食盐,过滤。
对两种方法的评价正确的是(选填编号)_____________。
a.方法一析出的氯化铵纯度更高 b.方法二析出的氯化铵纯度更高
c.方法一的滤液可直接循环使用 d.方法二的滤液可直接循环使用
②提取的NH4Cl中含有少量Fe2+、SO42―。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。加热至沸的目的是___________。滤渣的主要成分是_______________、____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com