
| A. | 明矾作净水剂 | |
| B. | 黄河入海口处容易形成沙洲 | |
| C. | 可用半透膜除去淀粉溶液中的少量NaCl | |
| D. | 将植物油倒入水中用力搅拌可形成油水混合物 |
分析 可根据胶体的性质来分析解答,向胶体中加入电解质可以使胶体凝聚,胶体粒子带电可用于净水,
A.明矾是硫酸铝,水溶液中铝离子水解生成氢氧化铝胶体具有吸附悬浮杂质作用;
B.胶体遇到电解质溶液发生聚沉;
C.淀粉胶体不能通过半透膜;
D.将植物油倒入水中,油不溶于水,用力搅拌可形成油水混合物为乳浊液.
解答 解:A.因明矾水解生成氢氧化铝胶体,胶粒带电,可以吸附水中带相反电荷的杂质,所以明矾可净水,故A不选;
B.河流中的水含有泥沙胶粒,海水中含有氯化钠、氯化钙等电解质,二者相遇是可以发生胶体凝聚,就形成三角洲,故B不选;
C.胶体微粒直径1-100nm,不能通过半透膜,溶液微粒直径小于1nm,能通过半透膜,可以分类胶体和溶液,故C不选;
D.植物油、水的混合物属于乳浊液,不属于胶体,故D选;
故选D.
点评 本题主要考查了学生对胶体性质的掌握情况及利用胶体性质对生产生活中实际问题进行解释,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
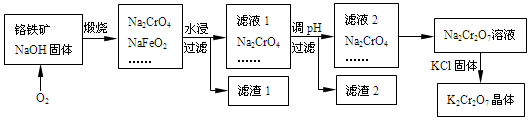
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 气体摩尔体积在非标准状况下也有可能是22.4L/mol | |
| C. | 在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类 | |
| D. | 物质的量是国际单位制中七个基本物理量之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com