
| 选项 | 实验 | 现象 | 结论 |
| A | 将FeCl3溶液加入Mg(OH)2悬浊液中 | 观察到沉淀由白色变为红褐色 | Fe(OH)3的溶解度大于Mg(OH)2 |
| B | 向某溶液中滴加BaCl2溶液,随后加稀硝酸酸化 | 溶液中产生白色沉淀,加稀硝酸不溶解 | 原溶液中一定含有SO42- |
| C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2比Fe3+强 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.FeCl3溶液加入Mg(OH)2悬浊液中,发生沉淀的转化,生成溶解度更小的物质;
B.可能生成AgCl沉淀;
C.硝酸根离子在酸性条件下具有强氧化性;
D.生成碳酸钡沉淀,碳酸根离子浓度变化.
解答 解:A.FeCl3溶液加入Mg(OH)2悬浊液中,发生沉淀的转化,观察到沉淀由白色变为红褐色,可验证Fe(OH)3的溶解度小于Mg(OH)2,故A错误;
B.加入氯化钡,可能生成AgCl沉淀,应加入硝酸钡,且先加入盐酸酸化,以此来检验硫酸根离子,故B错误;
C.硝酸根离子在酸性条件下具有强氧化性,不能检验过氧化氢的氧化性,故C错误;
D.加入少量BaCl2固体,生成碳酸钡沉淀,水解平衡逆向移动,溶液红色变浅,证明Na2CO3溶液中存在水解平衡,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、离子检验、氧化还原反应、盐类水解为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 5; 0.1 | B. | 5; 0.2 | C. | 3<x<5; 0.1 | D. | 3<x<5; 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
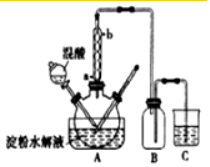
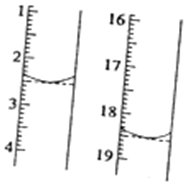
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl═NaCl+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
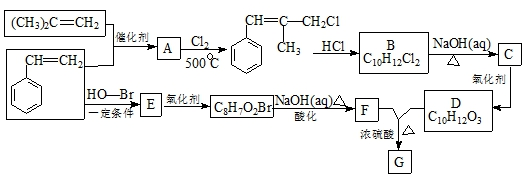
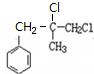 ,B生成C的反应类型为取代反应;
,B生成C的反应类型为取代反应;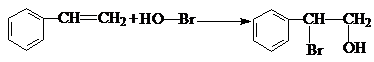 .
.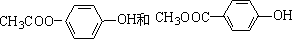 .
. ) 的合成线路:
) 的合成线路: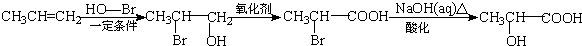 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+(Al3+),加过量的氨水,过滤 | |
| B. | KCl溶液(BaCl2),加入足量K2SO4溶液,过滤 | |
| C. | CO2(SO2),饱和碳酸钠溶液,浓硫酸,洗气 | |
| D. | MgCl2溶液(Fe3+):加MgO固体,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用萃取的方法分离煤油和汽油 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体的混合物 | |
| D. | 向某溶液中先加BaCl2溶液,若有白色沉淀,再加稀盐酸,沉淀不溶解,可检验其中含有SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 立方烷是新合成的一种烃,其分子呈正立方体结构.如图所示:
立方烷是新合成的一种烃,其分子呈正立方体结构.如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com