
 营养平衡、科学使用食品添加剂有助于健康和提高免疫力.
营养平衡、科学使用食品添加剂有助于健康和提高免疫力.分析 ①食品中常用的防腐剂有:苯甲酸、苯甲酸钠等;
②维生素C可使碘的淀粉溶液蓝色褪去,说明碘被还原,则维生素C具有还原性;
③位于“平衡膳食宝塔”顶层、应该少吃的一类食物是油脂类,含较多的脂肪,如果多吃,会造成脂肪堆积,导致肥胖.
解答 解:①常用作食品防腐剂的是苯甲酸,故选a;
②碘具有氧化性,碘的淀粉溶液蓝色褪去,说明碘被还原,维生素C具有还原性,维生素C被氧化,故选c;
③“中国居民平衡膳食宝塔”(如图1),位于第“5”层即顶层,且每天不超过25g的能量物质是油脂,故选b.
点评 本题主要考查了食品添加剂、维生素以及膳食平衡,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:多选题
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 用石墨作电极电解AlCl3溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| D. | FeCl3溶液用于蚀刻印刷电路:Cu+2Fe3+═Cu2++2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4b}{a}$g•cm-3 | B. | $\frac{22400+17ab}{17000a}$g•cm-3 | ||
| C. | $\frac{22400+17ab}{a}$ g•cm-3 | D. | $\frac{22400b+17ab}{1000a}$g•cm-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 或
或 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe3+>SO2>I2 | B. | Cl2>Fe3+>I2>SO2 | C. | Cl2>I2>Fe3+>SO2 | D. | Fe3+>I2>Cl2>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
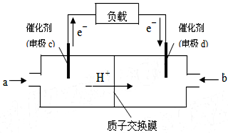
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量CO2通入过量氨水中:NH3•H2O+CO2=${NH}_{4}^{+}$+${HCO}_{3}^{-}$ | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合加热:${HSO}_{3}^{-}$+OH-=${SO}_{3}^{2-}$+H2O | |
| C. | 溴化亚铁溶液中通入少量Cl2:Cl2+2Br-=2Cl-+Br2 | |
| D. | 含1mol KOH的溶液与含2mol Ba(HCO3)2的溶液混合:Ba2++${2HCO}_{3}^{-}$+2OH-=BaCO3↓+${CO}_{3}^{2-}$+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com