

分析 由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,⑪为F,
(1)稀有气体的性质最稳定,F的非金属性最强,K的金属性最强;
(2)金属性越强,对应碱的碱性越强;
(3)电子层越多,原子半径越大,同周期从左向右原子半径减小;
(4)氢氧化铝能与强酸、强碱反应生成盐与水,Al元素对应的盐有铝盐、偏铝酸盐,Al元素均为+3价;氧化铝与盐酸反应生成氯化铝与水;氯化铝溶液中缓缓滴加NaOH至过量,先生成氢氧化铝沉淀,后氢氧化铝与氢氧化钠反应而溶解.
解答 解:由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,⑪为F,
(1)稀有气体的性质最稳定,F的非金属性最强,K的金属性最强,K与水反应生成氢氧化钾与氢气,反应离子方程式为2K+2H2O=2K++2OH-+H2↑,
故答案为:Ar;F;2K+2H2O=2K++2OH-+H2↑;
(2)金属性越强,对应碱的碱性越强,则①③⑤三种元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是NaOH,
故答案为:NaOH;
(3)电子层越多,原子半径越大,同周期从左向右原子半径减小,则①②③三种元素的原子半径由大到小的顺序是K>Na>Mg,
故答案为:K;Na;Mg;
(4)氢氧化铝能与强酸、强碱反应生成盐与水,Al元素对应的盐有铝盐、偏铝酸盐,Al元素均为+3价;氧化铝与盐酸反应生成氯化铝与水,反应方程式为:Al2O3+6HCl=2AlCl3+3H2O,离子方程式为:Al2O3+6H+=2Al3++3H2O,氯化铝溶液中缓缓滴加NaOH至过量,先生成氢氧化铝沉淀,后氢氧化铝与氢氧化钠反应而溶解,现象为:先出现白色沉淀,并逐渐增多,后逐渐减少,最后消失,反应方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al;+3;Al2O3+6H+=2Al3++3H2O;先出现白色沉淀,并逐渐增多,后逐渐减少,最后消失;AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氨水与稀盐酸反应 | B. | H2SO4与Al(OH)3反应 | ||
| C. | 澄清石灰水与稀硝酸反应 | D. | NaOH与CH3COOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
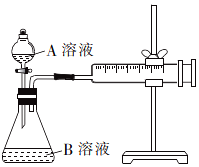 草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.| 实验编号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
| ② | 2mL 0.2mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
| 实验编号 | 10%硫酸的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | - |
| Ⅱ | 2 | 20 | 少量MnSO4粉末 |
| Ⅲ | 2 | 30 | - |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
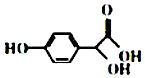
| A. | M能发生酯化、加成、氧化反应 | |
| B. | 用碳酸氢钠不能检验M分子中存在羧基 | |
| C. | M的分子式为C8H8O4 | |
| D. | M的苯环上一氯代物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z | |
| B. | X元素的一种单质可用于消毒杀菌 | |
| C. | Y的单质在空气中放置表面易生成一层致密的氧化膜 | |
| D. | Z的单质在氧气中点燃可生成两种酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 稀HNO3氧化能力弱于浓HNO3 | |
| C. | 贮存铵态氮肥时要密封保存,并放在阴凉处 | |
| D. | 硝酸只能被Zn、Fe等金属还原成H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.3g | B. | 25.4g | C. | 28.6g | D. | 50.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是高纯度的二氧化硅 | |
| B. | 古有“靑蒿一握,以水二升漬,绞取汁”,今用乙醚从黄花蒿中提取靑蒿素是利用氧化还原反应原理 | |
| C. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 | |
| D. | 纤维素作为营养物质,在人体内不断分解,最终生成水和二氧化碳排出体外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com