
| m |
| n |
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
 ,元素⑩的次外层电子数为14个;
,元素⑩的次外层电子数为14个; ;14;
;14;

科目:高中化学 来源: 题型:
| A、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、FeCl3溶液刻蚀铜制的印刷电路板:Cu+Fe3+=Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
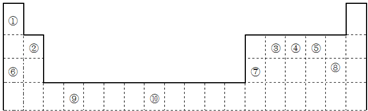
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
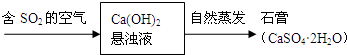
 喷泉是一种常见的自然现象,其产生原因是存在压强差.
喷泉是一种常见的自然现象,其产生原因是存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:
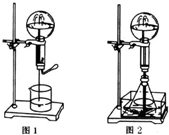
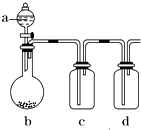 有几个实验小组的同学,利用右图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.
有几个实验小组的同学,利用右图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,由0.1mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH?B++OH- |
| B、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D、将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com