
【题目】(1)下列说法正确的是
A.化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,必然伴随着能量的变化
B.钢铁生锈腐蚀时,铁被氧化
C.放热反应发生时,不一定要加热。但吸热反应必须要加热才能发生
(2)在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为 。
(3)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g);如图表示该反应进行过程中能量的变化。(单位为:kJ·mol1)该反应是 (填“吸热”或“放热”)反应,ΔH 0(填“>”或“<”)。
CH3OH(g) +H2O(g);如图表示该反应进行过程中能量的变化。(单位为:kJ·mol1)该反应是 (填“吸热”或“放热”)反应,ΔH 0(填“>”或“<”)。

(4)比较下面各组热化学方程式,ΔH1<ΔH2的是 。
A.2H2(g) + O2(g) ![]() 2H2O(g) ΔH1 2H2(g) + O2(g)
2H2O(g) ΔH1 2H2(g) + O2(g) ![]() 2H2O(1) ΔH2
2H2O(1) ΔH2
B.S(g) + O2(g) ![]() SO2(g ) ΔH1 S(s) + O2(g)
SO2(g ) ΔH1 S(s) + O2(g) ![]() SO2(g ) ΔH2
SO2(g ) ΔH2
C.C(s) +![]() O2(g)
O2(g) ![]() CO (g ) ΔH1 C(s) +O2(g)
CO (g ) ΔH1 C(s) +O2(g) ![]() CO2 (g ) ΔH2
CO2 (g ) ΔH2
D.H2(g) + Cl2(g) ![]() 2HCl(g ) ΔH1
2HCl(g ) ΔH1 ![]() H2(g) +
H2(g) +![]() Cl2(g)
Cl2(g) ![]() HCl(g) ΔH2
HCl(g) ΔH2
(5)101 kPa条件下,14 g N2和3 g H2反应生成NH3的能量变化如图示意:

又已知:①已知b=1173;②25℃、101 kPa下N2(g)+3H2 (g) ![]() 2 NH3 (g) ΔH =-92 kJ·mol1,则a = 。
2 NH3 (g) ΔH =-92 kJ·mol1,则a = 。
【答案】(1)AB (2)2H2(g) + O2(g) ![]() 2H2O(1) ΔH =571.6 kJ·mol1
2H2O(1) ΔH =571.6 kJ·mol1
(3)放热 < (4)BD (5)1127
【解析】本题主要考查的是热化学方程式的书写和有关反应热的计算。
(1)化学反应的实质就是旧化学键的断裂及新化学键的形成,同时必然伴随着能量的变化,故A正确;钢铁生锈腐蚀时发生氧化反应,故B正确;放热反应发生时,不一定要加热,吸热反应发生时也不一定要加热,故C错;故答案为AB 。
(2)2 g H2为1 mol,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,则其燃烧的热化学方程式表示为2H2(g) + O2(g) ![]() 2H2O(1) ΔH =571.6 kJ·mol1。
2H2O(1) ΔH =571.6 kJ·mol1。
(3)由图可知,反应物的总能量大于生成物的总能量,所以该反应是放热反应,ΔH<0。
(4)A.物质的燃烧反应是放热反应,焓变是负值,液态水变为气态水的过程是吸热的,故ΔH1>ΔH2;B.物质的燃烧反应是放热反应,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以ΔH1<ΔH2;C.碳完全燃烧生成CO2,比不完全燃烧生成CO放出的热量多,所以ΔH1>ΔH2;D.化学反应方程式的计量数减半,焓变数值也减半,该化合反应是放热的,焓变是负值,ΔH1=2ΔH2,所以ΔH1<ΔH2;故正确答案为BD。
(5)化学反应的反应热ΔH=反应物的总键能生成物的总键能,所以-92![]() =ab,由于b=1173,所以a=1127,故答案为1127。
=ab,由于b=1173,所以a=1127,故答案为1127。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硫及其化合物对人类的生产和生活有着重要的作用.
2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1是制备硫酸的重要反应.
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2 , 反应在不同条件下进行,反应体系总压强随时间的变化如下图所示.与实验a相比,实验b改变的条件是 , 判断的依据 . 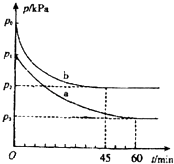
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)SO3(g)+NO(g)△H=﹣42kJmol﹣1 .
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
N(SO2) | N(NO2) | N(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T3 | 0.20 | 0.30 | a |
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)= , 该温度下的平衡常数 .
②实验丙中,达到平衡时,NO2的转化率为 .
③由表中数据可推知,TlT2(填“>”“<’’或“=”),判断的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。请回答下列问题:
(1)生成物能量总和________(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的标准燃烧热ΔH=________。
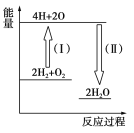
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。
则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述中正确的是( ) 
A.该有机物属于芳香烃
B.该物质不能使酸性高锰酸钾溶液褪色
C.该分子对称性好,所以没有顺反异构
D.该有机物分子中,最多可能有18个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。
已知:①P4(白磷,s)+5O2(g)![]() P4O10(s) ΔH=2 983.2 kJ·mol1
P4O10(s) ΔH=2 983.2 kJ·mol1
②P(红磷,s)+![]() O2(g)
O2(g)![]()
![]() P4O10(s) ΔH=738.5 kJ·mol1
P4O10(s) ΔH=738.5 kJ·mol1
则白磷转化为红磷的热化学方程式为
A.P4(白磷,s)![]() 4P(红磷,s) ΔH=29.2 kJ·mol1
4P(红磷,s) ΔH=29.2 kJ·mol1
B.P4(白磷,s)![]() 4P(红磷,s) ΔH=+29.2 kJ·mol1
4P(红磷,s) ΔH=+29.2 kJ·mol1
C.P4(白磷,s)![]() 4P(红磷,s) ΔH=2 244.7 kJ·mol1
4P(红磷,s) ΔH=2 244.7 kJ·mol1
D.P4(白磷,s)![]() 4P(红磷,s) ΔH=+2244.7 kJ·mol1
4P(红磷,s) ΔH=+2244.7 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁都是含碳物质。其中丁是一种有机物,甲、乙、丁都能发生燃烧生成丙,同时放出大量的热,甲与丙反应时需要吸收热量。则甲、乙、丙、丁分别是 ( )
A.CO,C,CO2,CH4B.C,CO2,CH4,CO
C.C,CO,CO2,CH4D.C,O2,CO2,CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验,能成功的是
A.苯和溴水、铁屑混合制溴苯
B.用溴水除乙烷中混有的乙烯
C.苯与浓硝酸和浓硫酸的混合物共热至70℃~80℃制硝基苯
D.用酒精和浓盐酸通过加热来制取乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com