
【题目】下图中的电化学装置以甲醇(CH3OH)为主要原料合成碳酸二甲酯[(CH3O)2CO],相关说法错误的是
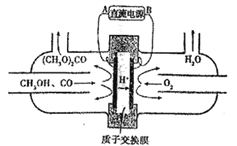
A. B是直流电源的负极
B. 碳酸二甲酯中碳均为+4价
C. 阳极附近溶液pH降低
D. 每当有2molH+通过离子交换膜,消耗氧气的体积在标准状况下为11.2L
【答案】B
【解析】试题分析:由题意知,该装置可以用甲醇、CO和氧气合成碳酸二甲酯,其中氧气是氧化剂发生还原反应。由图中信息可知,甲醇从与A相连的电极通入,氧气从与B相连的电极通入,所以A为正极、B为负极。A. B是直流电源的负极,A正确;B. 碳酸二甲酯中,羰基上的碳显+4价,甲基中的碳为-2价,分子中碳的平均化合价为0,B不正确;C. 阳极的电极反应为2CH3OH+CO-2e- =(CH3O)2CO+2H+,所以阳极附近溶液pH降低,C正确;D. 由前面的分析可知,每当有2molH+通过离子交换膜,电路中就有2mole-通过,所以阴极就消耗0.5mol氧气,0.5mol氧气的体积在标准状况下为11.2L,D正确。本题选B。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】碳酸锶主要用于彩电显像管的荧屏玻璃和特种玻璃等的制造,通常由天青石矿(主要成分为SrSO4,还含有钡等杂质)制备,制备流程如图所示:
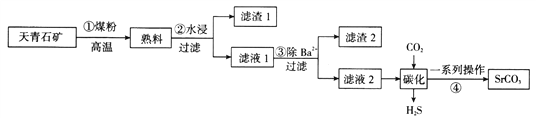
已知:i.锶在“滤液1”“滤液2”中均主要以Sr(HS)2、Sr(OH)2形式存在
ii.SrSO4、BaSO4的KSP分别是3.2×10-7、1.0×10-10
回答下列问题:
(1)步骤①反应:SrSO4+2C![]() SrS+2CO2↑,若在标准状况下产生3.36 LCO2,则转移电子数为__________________。
SrS+2CO2↑,若在标准状况下产生3.36 LCO2,则转移电子数为__________________。
(2)写出步骤②中“水浸”主要反应的化学方程式:________________________。步骤②“过滤”操作需要的主要玻璃仪器为________________________。
(3)上述生产工艺的优点是质量好、成本低,但从环保角度考虑该工艺生产存在明显的缺点是______________________________________________________。
(4)若向含有Sr2+、Ba2+的“滤液1”中滴加稀硫酸,当两种沉淀共存时,c(Sr2+):c(Ba2+)=________________。
(5)写出“碳化”过程中发生反应的化学方程式:_______________________________。
(6)某生产企业用a kg的天青石矿(含SrSO4:40%)制备,最终得到b kg碳酸锶产品,产率为______________(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉和纤维素不属于同分异构体的原因是 ( )
A. 组成的元素不同 B. 物理性质、化学性质不同
C. 组成的单糖单元数不相同 D. 分子结构不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法不正确的是
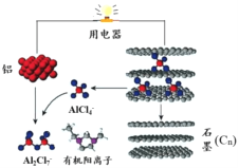
A. 放电时,铝为负极,石墨为正极
B. 放电时的负极反应为:Al-3e-+7AlCl4-===4Al2Cl7-
C. 充电时的阳极反应为:Cx+ AlCl4--e-===CxAlCl4
D. 放电时,有机阳离子向铝电极方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杨梅醛是常用的水果型食用香精,合成路线如下。
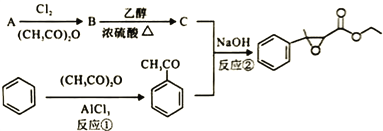
(1)杨梅醛的分子式为______________。
(2)与![]() 互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
互为同分异构体的芳香醛有___________种,用于鉴别这些同分异构体的方法为___________。
(3)反应①的反应类型为___________,该反应的另一产物在合成中可循环利用,其结构简式为___________。
(4)已知反应②的另一产物不含碳原子,B中含有的官能团为__________ (填名称),C的结构简式为___________。
(5)写出反应②的化学方程式___________。
(6)写出两种符合以下条件的杨梅醛的同分异构体的结构简式___________。
i.与FeCl3发生显色反应且能发生银镜反应
ⅱ.有三个互为间位的取代基且每个取代基含一个官能团
ⅲ含有-CH3和-CHO基团各两个
(7)根据上述合成路线写出乙酐和A为原料制备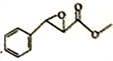 的合成路线____________(其试剂任选)。
的合成路线____________(其试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保护加酶洗衣粉洗涤效果,应注意
A. 使用沸水先冲泡洗衣粉 B. 用含氯较高的自来水作水源
C. 和其他洗涤剂混合使用 D. 室温时用饮用水先溶解洗衣粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图所示。
]的关系如图所示。

①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ molL-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)

①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组数据中比值为2:1的是( )
A. 0.2 mol/L的CH3COONa溶液与0.1 mol/L的CH3COONa溶液中c(CH3COO-)之比
B. pH=7的氨水与(NH4)2SO4的混合溶液中c(NH4+)与c(SO42-)之比
C. 等质量的Na2CO3固体和NaHCO3固体分别与足量盐酸反应,消耗盐酸的物质的量之比
D. pH均为2的H2SO4溶液与盐酸中c(H+)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分

(1)⑤⑥⑦⑨⑩的离子半径由大到小的顺序为______________________(用离子符号表示)。
(2)③与⑩形成的一种化合物每个原子最外层都满足8e-结构,写出该化合物的电子式________。
(3)①②两种元素以原子个数比为3:1形成的一种化合物,写出其二氯取代物的结构简式:_____。
(4)与③同主族的元素的化合物亚磷酸H3PO3是二元弱酸,写出H3PO3与过量的NaOH溶液反应的离子方程式__________________________________。
(5)由④⑥两种元素组成的一种化合物加入到硫酸亚铁溶液中,产生红褐色沉淀,但无气体产生,写出该反应的离子方程式__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com