
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA
B.5.8g熟石膏(2CaSO4 H2O)含有的结晶水分子数为0.02NA
C.4.6g C2H6O中含C-H键数为0.6NA
D.1L甲醛气体完全燃烧消耗O2的数目约为![]()
【答案】B
【解析】
A.浓硫酸与锌发生反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,当反应进行到一定程度变为稀硫酸时发生反应:Zn+H2SO4(稀)=ZnSO4+H2↑, n(H2SO4)=cV=16mol/L×0.0125L=0.2mol,若完全发生第一个反应,转移电子的数目为0.2NA,若发生第二个反应,转移电子数目为0.4NA,因此反应转移电子数目大于0.2NA,小于0.4NA,故A错误;
B.熟石膏(2CaSO4 H2O)摩尔质量是290g/mol,则5.8g熟石膏的物质的量n=![]() =0.02mol,由于熟石膏中(2CaSO4 H2O)~H2O,所以0.02mol该物质中含有的结晶水分子数为0.02NA,故B正确;
=0.02mol,由于熟石膏中(2CaSO4 H2O)~H2O,所以0.02mol该物质中含有的结晶水分子数为0.02NA,故B正确;
C.C2H6O相对分子质量都是92,则4.6g C2H6O物质的量是0.1mol,由于C2H6O可能有的结构为CH3CH2OH和CH3OCH3,两种结构中1分子含有的C-H键分别为5个和6个,所以4.6g C2H6O中含C-H键数不一定为0.6NA,故C错误;
D.甲醛气体,若在标准状况下1L的物质的量为n(甲醛)=![]() ,1mol甲醛完全燃烧消耗1mol O2,则1L甲醛气体完全燃烧消耗O2的物质的量是
,1mol甲醛完全燃烧消耗1mol O2,则1L甲醛气体完全燃烧消耗O2的物质的量是![]() ,消耗氧气的分子个数约为
,消耗氧气的分子个数约为![]() ,而题目中缺少“在标准状况下”限制,故D错误;
,而题目中缺少“在标准状况下”限制,故D错误;
答案选B。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
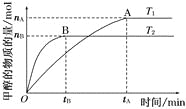
下列说法正确的是_______(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质是构成生物体的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)在基态![]() 原子中,核外电子占据的最高能级的电子云轮廓图为________形。
原子中,核外电子占据的最高能级的电子云轮廓图为________形。
(2)常见的含氮微粒有![]() 、
、![]() 、
、![]() 等。与
等。与![]() 互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知
互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知![]() 的空间构型为________,
的空间构型为________,![]() 比
比![]() 更容易液化的原因是________。
更容易液化的原因是________。
(3)将足量的氨水逐滴加入到![]() 溶液中,先生成沉淀,然后沉淀溶解生成配合物
溶液中,先生成沉淀,然后沉淀溶解生成配合物![]() ,该配合物中的阳离子结构式为________;
,该配合物中的阳离子结构式为________;![]() 中的硫原子杂化方式为________;用价层电子对互斥理论解释
中的硫原子杂化方式为________;用价层电子对互斥理论解释![]() 的键角大于
的键角大于![]() :________。
:________。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:晶胞中与Zn原子距离最近的Te原子围成________形;与Te原子距离最近的Te原子有________个;若与Zn原子距离最近的Te原子间距为apm,则晶体密度为________![]() (列出计算式即可)。
(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
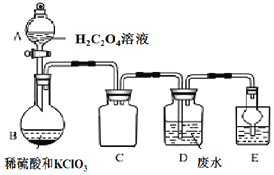
【题目】某工业废水中含有的 Mn2+、CN﹣等会对环境造成污染,在排放之前必须进行处理。ClO2是一种国际上公认的安全无毒的绿色水处理剂,某实验兴趣小组通过如图装置制备 ClO2,并用它来处理工业废水中的 Mn2+、CN﹣。
已知:i.ClO2 为黄绿色气体,极易溶于水,沸点 11℃;
ii.ClO2 易爆炸,若用“惰性气体”等稀释时,爆炸性则大大降低;
iii.某工业废水处理过程中 Mn2+转化为 MnO2、CN﹣转化为对大气无污染的气体;
iv.装置 B 中发生的反应为:H2C2O4+H2SO4+2KClO3═K2SO4+2CO2↑+2ClO2↑+2H2O。
请回答下列问题:
(1)B 装置的名称是_____,C 装置的作用为_____。
(2)用 H2C2O4 溶液、稀硫酸和 KC1O3 制备 ClO2 的最大优点是_____。
(3)写出装置 D 中除去 Mn2+的离子方程式_____。
(4)ClO2 在处理废水过程中可能会产生副产物亚氯酸盐(ClO2 )。下列试剂中,可将 ClO2 转化为 Cl
的是_____。(填字母序号)。
a.FeSO4 b.O3 c.KMnO4 d.SO2
(5)在实验室里对该废水样品中 CN﹣含量进行测定:取工业废水Wg于锥形瓶中,加入10mL0.10mol/L 的硫酸溶液,用 0.0200mol/L 的 KMnO4标准溶液进行滴定,当达到终点时共消耗 KMnO4 标准溶液25.00mL。
在此过程中:
①实验中使用棕色滴定管的原因是_____,滴定终点的判断依据是_____。
②W g 工业废水中 CN﹣的物质的量为_____。
③若盛装工业废水的锥形瓶未润洗,则测定结果将_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
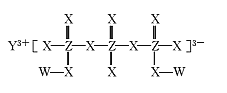
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,反应CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2![]() CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H

①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCN(aq)+NaOH(aq)=NaCN(aq)+H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;
则HCN在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1B.-45.2 kJ·mol-1C.+45.2 kJ·mol-1D.+69.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种全天候太阳能电池光照时的工作原理如图所示。
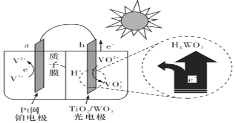
下列说法不正确的是( )
A.硅太阳能电池供电原理与该电池相同
B.光照时,b极的电极反应式为VO2+﹣e-+H2O=VO2++2H+
C.光照时,毎转移1mol电子,有2molH+由b极区经质子交换膜向a极区迁移
D.夜间时,该电池相当于蓄电池放电,a极发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com