
 X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:| 元素 | 相关信息 |
| X | 其中一种核素在考古时常用来鉴定一些文物的年代 |
| Y | 原子核外电子有7种不同的运动状态 |
| Z | 地壳中含量最高的元素 |
| W | 价电子排布式为(n+1)sn(n+1)p(n+1) |
| R | 基态原子最外能层只有一个电子,其他能层均已充满电子 |
分析 X、Y、Z、W、R是原子序数依次增大的前四周期元素,X的一种核素在考古时常用来鉴定一些文物的年代,则X为碳元素;Y原子核外电子有7种不同的运动状态,则Y为N元素;Z是地壳中含量最高的元素,则Z为O元素;W元素的价电子排布式为(n+1)sn(n+1)p(n+1),s能级容纳2个电子,则n=2,可推知W为P元素;R元素的基态原子最外能层只有一个电子,其它能层均已充满,则R原子外围电子排布为3d104s1,所以F为铜元素.
(1)根据核外电子排布规律书写;
(2)N2分子结构式为N≡N,三键含有1个σ键、2个π键;
(3)同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素;氨气分子之间存在氢键,沸点高于甲烷的,
(4)由元素Z、W组成PO43-,计算P原子孤电子对数、价层电子对数,确定空间构型及P原子的杂化方式;
(5)根据均摊法计算晶胞中Cu、O原子数目,进而确定化学式;
表示出晶胞质量,若相邻氧原子和铜原子间的距离为a cm,则晶胞的体对角线为4acm,所以边长为$\frac{4a}{\sqrt{3}}$cm,
再根据ρ=$\frac{m}{V}$计算.
解答 解:X、Y、Z、W、R是原子序数依次增大的前四周期元素,X的一种核素在考古时常用来鉴定一些文物的年代,则X为碳元素;Y原子核外电子有7种不同的运动状态,则Y为N元素;Z是地壳中含量最高的元素,则Z为O元素;W元素的价电子排布式为(n+1)sn(n+1)p(n+1),s能级容纳2个电子,则n=2,可推知W为P元素;R元素的基态原子最外能层只有一个电子,其它能层均已充满,则F原子外围电子排布为3d104s1,所以R为铜元素.
(1)R元素的基态原子最外能层只有一个电子,其它能层均已充满,基态R原子的电子排布式为1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)N2分子结构式为N≡N,σ键和π键的数目比为1:2,故答案为:1:2;
(3)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:C<O<N;
氨气分子之间存在氢键,沸点高于甲烷的,
故答案为:C<O<N;氨气分子之间存在氢键;
(4)由元素Z、W组成的PO43-中P原子孤电子对数为$\frac{5+3-2×4}{2}$=0,价层电子对数为4+0=4,故其空间构型是正四面体,其中P原子的杂化类型为sp3杂化,
故答案为:正四面体;sp3杂化;
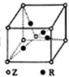
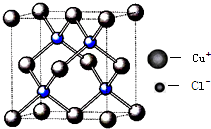
(5)根据晶胞的结构图可知,晶胞中含有氧原子数为1+8×$\frac{1}{8}$=2,铜原子数为4,所以该化合物的化学式为Cu2O,晶胞质量为(4×$\frac{64}{{N}_{A}}$+2×$\frac{16}{{N}_{A}}$)g,若相邻氧原子和铜原子间的距离为a cm,则晶胞的体对角线为4acm,所以边长为$\frac{4a}{\sqrt{3}}$cm,所以体积为($\frac{4a}{\sqrt{3}}$)3cm3,该晶体的密度为(4×$\frac{64}{{N}_{A}}$+2×$\frac{16}{{N}_{A}}$)g÷($\frac{4a}{\sqrt{3}}$)3cm3=$\frac{27\sqrt{3}}{2{a}^{3}{N}_{A}}$g/cm3,
故答案为:Cu2O;$\frac{27\sqrt{3}}{2{a}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、杂化轨道、氢键度物质性质的影响、晶胞的计算等,中等难度,元素推断是解题的关键,需要学生具备扎实的基础,(3)中注意利用均摊法计算晶胞质量,关键是计算晶胞体积.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
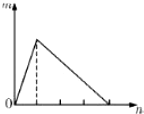 将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的量m与加入X的物质的量n的关系如图所示,符合图中情况的一组物质是( )
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的量m与加入X的物质的量n的关系如图所示,符合图中情况的一组物质是( )| A | B | C | D | |
| X | Ba(OH)2 | NaOH | NH3 | HCl |
| Y | 明矾 | AlCl3 | MgSO4 | NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,22gCO2含碳氧双键数目为2NA | |
| B. | 12.0gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状况下,22.4LBr2中所含分子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾、硫酸铁作净水器 | |
| B. | 医用双氧水做杀菌消毒剂 | |
| C. | 铁粉、碳粉和氯化钠的混合物作食品的去氧剂 | |
| D. | CaO2作运输水产品的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com