
| A. | 饱和溶液的物质的量浓度$\frac{100a(Mr-18x)}{MrV}$ | |
| B. | 饱和溶液的质量分数$\frac{a(Mr-18x)}{(a+b)Mr}$ | |
| C. | 25℃,R的溶解度$\frac{100a(Mr-18x)}{(bMr+18ax)}$ | |
| D. | 饱和溶液的密度$\frac{a+b}{V}$ |
分析 根据结晶水合物的相对分子质量和质量可求解物质的量,根据C=$\frac{n}{V}$、质量分数=$\frac{溶质质量}{溶液质量}$、溶解度等于100g水中溶解溶质的质量、$ρ=\frac{m}{V}$进行有关计算.
解答 解:A.溶质的物质的量=$\frac{a}{Mr}$momol,溶液的物质的量浓度为:$\frac{\frac{a}{Mr}}{V×1{0}^{-3}}$=$\frac{1{0}^{3}a}{MrV}$,故A错误;
B.溶质的质量=a×$\frac{Mr-18x}{Mr}$=$\frac{a(Mr-18x)}{Mr}$g,所以饱和溶液的质量分数=$\frac{a(Mr-18x)}{(a+b)Mr}$,故B正确;
C.溶质的质量=a×$\frac{Mr-18x}{Mr}$=$\frac{a(Mr-18x)}{Mr}$g,溶剂的质量=$\frac{18xa}{Mr}$+bg,所以其溶解度=$\frac{100×\frac{a(Mr-18x)}{Mr}}{\frac{18ax}{Mr}+b}$=$\frac{100a(Mr-18x)}{(bMr+18ax)}$g,故C正确;
D.溶液的质量=(a+b)g,溶液的密度=$\frac{a+b}{V}$g/mL,故D正确;
故选A.
点评 本题考查物质的有关计算,明确公式表达式是解本题关键,难度较大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:解答题
 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节.
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
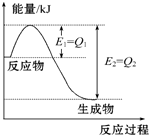 如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.
如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| ① | 30 | 20 | 30 | 20 | 18 | |
| ② | 30 | 20 | 30 | 20 | 温度65℃ | 13 |
| ③ | 30 | 20 | 30 | 20 | 少量MnSO4固体 | 3.6 |
| ④ | 30 | 20 | x | 20 | 5mL 10mol/L K2SO4溶液 | 18 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、CuSO4、HCl、KNO3 | B. | HCl、KOH、NaCl、Na2SO4 | ||
| C. | Ca(OH)2、Na2CO3、NaCl、HCl | D. | NaNO3、MgCl2、KCl、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置:
甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2 | B. | SO2 | C. | O2和SO2 | D. | O2、SO2和SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 乙醛溶液与足量的银氨溶液共热:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH4++2Ag↓+3NH3+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com