
| 配料 | 水、果汁、白砂糖、食品添加剂 | |||||
| 项目 | 糖类 | 维生素 | 柠檬味酸 | 氯 | 钠 | 碘 |
| 每100g | 42.5g | 200mg | 100mg | 50mg | 90mg | 3.5mg |
分析 ①根据常量元素和微量元素所包括的种类,进行分析判断解答,柠檬味酸呈酸性;
②维生素C受热容易分解最佳食用方式是生食;
③检验是否含有淀粉用碘水.
解答 解:①人体中的常量元素主要有:氧、碳、氢、氮、钙、磷、钾、硫、钠、氯、镁;微量元素主要有:铁、钴、铜、锌、铬、锰、钼、氟、碘、硒,表中的微量元素是碘,
食品添加剂柠檬味酸呈酸性,其pH小于7,
故答案为:碘;小于;
②维生素C受热容易分解,生食蔬菜水果可防止维生素C破坏,
故答案为:生食;
③淀粉的特性是淀粉遇碘水变蓝色,因此可以用碘水来检验样品中是否含有淀粉,若变蓝色,说明食物中有淀粉,
故答案为:取少量样品滴加几滴碘水,若观察到蓝色则含淀粉.
点评 本题考查生活中的化学,涉及微量元素、维生素等,题目难度不大,注意淀粉遇碘液变蓝色的特性,注意化学与生活的联系.


科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)═SO2(l)|△H|<297.3 kJ•mol-1 | |
| B. | 1molSO2的键能总和大于1molS和1molO2键能之和 | |
| C. | S(s)+O2(g)═SO2(g)|△H|>297.3 kJ•mol-1 | |
| D. | 1molSO2的键能总和小于1molS和1molO2键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | Ba(OH)2═Ba2++2OH- | D. | Al2(SO4)3═3SO42-+2Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
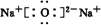 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
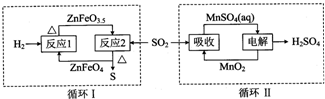 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 20 | 40 | 50 | 60 | 70 |
| MgSO4 | 25.0 | 31.8 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.256 | 0.212 | 0.207 | 0.201 | 0.190 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com