
把0.02 mol·L-1 CH3COOH溶液和0.01 mol·L-1 NaOH溶液以等体积混合,溶液呈酸性,混合溶液中粒子浓度关系正确的是( )
A.[CH3COO-]>[Na+]
B.[CH3COOH]>[CH3COO-]
C.2[H+]=[CH3COO-]-[CH3COOH]
D.[CH3COOH]+[CH3COO-]=0.02 mol·L-1
A [溶液混合后,二者反应,但CH3COOH过量,故为CH3COONa和CH3COOH的混合体系。CH3COOH和CH3COO-相互抑制,但以CH3COOH电离为主,溶液显酸性,即[H+]>[OH-],由电荷守恒[Na+]+[H+]=[CH3COO-]+[OH-],则有[CH3COO-]>[Na+],CH3COOH电离程度大于CH3COO-水解程度,B不正确;对于C项:由于存在[H+]+[Na+]=[OH-]+[CH3COO-]的电荷守恒①和2[Na+]=[CH3COO-]+[CH3COOH]的物料守恒②,联立①②两式可得:2[H+]=[CH3COO-]-[CH3COOH]+2[OH-],所以C错;D项看似是物料守恒,但溶液的体积是原来的2倍,则[CH3COOH]+[CH3COO-]=0.01 mol·L-1,D错误。]


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为2CH3CHO+H2O
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为2CH3CHO+H2O
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:①4OH--4e-====O2↑+2H2O
②
阴极:①
②CH3CHO+2e-+2H2O====CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”“减小”或“不变”)。
(4)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是 。
(5)在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛的含量为3 000 mg·L-1的废水,可得到乙醇 kg(计算结果保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
电解84.75 mL 16%的NaOH溶液(ρ=1.18 g·cm-3),用石墨作电极经过一段时间后溶液浓度为19.5%,这是因为( )
A.溶质增加了3.5 g
B.放出了22.4 L H2和11.2 L O2
C.NaOH比水消耗少
D.消耗18 g水
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
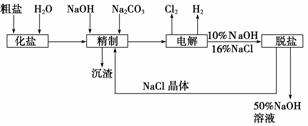
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为________________________,与电源负极相连的电极附近,溶液pH________(选填“不变”、“升高”或“下降”)。
(2)工业食盐中含Ca2+、Mg2+等杂质,精制过程中除去这些杂质时发生反应的离子方程式为________________________________________________________________________、
________________________________________________________________________。
(3)如果粗盐中SO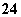 含量过高,必须添加钡试剂除去SO
含量过高,必须添加钡试剂除去SO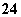 ,该钡试剂可以是________(填写字母序号,下同)。
,该钡试剂可以是________(填写字母序号,下同)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为有效除去Ca2+、Mg2+、SO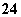 ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________
(填写操作名称)除去NaCl。
(6)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜法电解冷的食盐水时,Cl2与NaOH充分接触,得到的产物仅是NaClO和H2,则与该反应相应的化学方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中能大量共存的是( )
A.Ca2+、HCO 、Cl-、K+
、Cl-、K+
B.Al3+、[Al(OH)4]-、HCO 、Na+
、Na+
C.Fe2+、H+、SO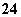 、S2-
、S2-
D.Fe3+、SCN-、Na+、CO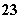
查看答案和解析>>
科目:高中化学 来源: 题型:
图中x、y分别是直流电源的两极,通电后发现a极板的质量增加,b极板处有无色、无臭气体放出,符合这一情况的是( )。
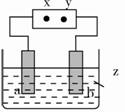
| a极板 | b极板 | x电极 | z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 )。
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同
A.③④⑦⑧ B.①③④⑦⑧
C.①②⑤⑥⑨ D.①④⑦⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和解释都正确的是(双选)( )
| 选项 | 实验操作 | 现象 | 解释 |
| A. | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO |
| B. | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| C. | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 上层呈紫红色,下层有白色沉淀生成 | 铜离子可以氧化碘离子,白色沉淀可能成为CuI |
| D. | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com