
| A. | 1molCl2与足量的铁粉反应,反应转移电子的数目为3NA | |
| B. | 室温时,足量Zn与浓硫酸反应共产生2mol气体,转移电子数为4NA | |
| C. | 7.8gNa2O2与足量水反应时转移电子数目为0.2NA | |
| D. | 1mol二氧化氮气体久置后在标准状况下的体积为22.4L |
分析 A、氯气和铁反应后变为-1价;
B、锌和浓硫酸反应生成二氧化硫;
C、求出过氧化钠的物质的量,然后过氧化钠和水反应时为歧化反应来分析;
D、NO2中存在平衡:2NO2?N2O4.
解答 解:A、氯气和铁反应后变为-1价,故1mol氯气反应转移2mol电子即2NA个,故A错误;
B、锌和浓硫酸反应生成二氧化硫,当生成1mol二氧化硫时转移2mol电子,故当生成2mol二氧化硫时,转移4mol电子即4NA个,故B正确;
C、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠和水反应时为歧化反应,故0.1mol过氧化钠转移0.1NA个电子,故C错误;
D、NO2中存在平衡:2NO2?N2O4,故1mol二氧化氮久置后在标况下的体积小于22.4L,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
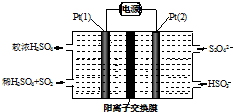 工业尾气SO2有多种吸收和处理方法.
工业尾气SO2有多种吸收和处理方法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是AlCl3溶液 | |
| B. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是H2SO4 | |
| C. | 若两支试管中都只产生白色沉淀时,则滴加的是Ba(0H)2溶液 | |
| D. | 若两支试管中既产生沉淀又出现气体时,则滴加的是NH4HCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
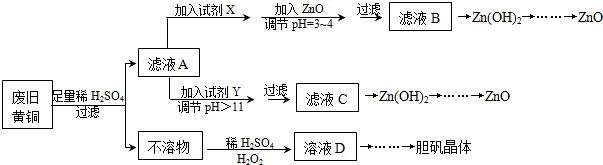
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=1.6,y=0.2,t<6 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | 实验1在前6 min的反应速率v (SO2)=0.2 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| B. |  实验:烧杯内Na2SiO3溶液变浑浊,可证明非金属性C>Si | |
| C. |  实驗:微笑热稀HN02,片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. |  实驗:利用该实驗装置可证明氧化性:Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
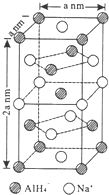 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.  .
.  .
.  (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
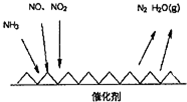
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com