
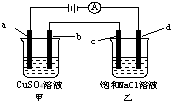
 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 当b极增重3.2 g时,d极产生的气体为0.56 L(标准状况) | |
| C. | 当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 甲烧杯中a电极反应式为:4OH--4e-═O2↑+2H2O |
分析 该电解池中,a极与正极相连为阳极,a极上氢氧根离子放电生成氧气,b电极与负极相连为阴极,b电极上铜离子放电生成铜;c电极与正极相连为阳极,c电极上氯离子放电生成氯气,d电极与负极相连为阴极,d电极上氢离子放电生成氢气,再结合转移电子相等计算.
解答 解:A.a电极上由水电离出的氢氧根离子放电生成氧气,导致a电极附近氢离子浓度增大,b电极上铜离子放电生成铜,所以甲中pH减小;c电极上氯离子放电生成氯气,d电极上由水电离出的氢离子放电生成氢气,导致d电极附近氢氧根离子浓度增大,溶液的pH增大,故A错误;
B.当b极增重3.2g时,铜离子得到电子的物质的量=$\frac{3.2g}{64g/mol}$×2=0.1mol,串联电路中转移电子相等,d极产生的气体体积=$\frac{0.1mol}{2}$=1.12L,故B错误;
C.当电解一段时间后,甲中溶质含有硫酸,可能含有硫酸铜,乙中含有氢氧化钠,可能含有氯化钠,二者混合时,可能产生氢氧化铜沉淀,故C错误;
D.甲中,a极上氢氧根离子放电生成氧气,电极反应式为4OH--4e-═O2↑+2H2O,故D正确;
故选D.
点评 本题考查了电解原理,明确各个电极上放电的离子及溶液中氢离子和氢氧根离子浓度的变化是解本题关键,再结合转移电子相等进行计算,难度中等,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 除①外其它都可以 | B. | 只有②③⑤ | C. | 只有①④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
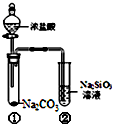
| A. | 向Na2SiO3溶液中直接滴入盐酸溶液无明显现象 | |
| B. | 试管①中反应的离子方程式是:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 该实验可以证明酸性:盐酸>碳酸>硅酸 | |
| D. | 一段时间后试管②中有胶冻状物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
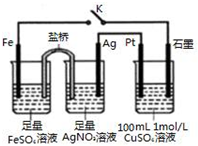
| A. | 盐桥中的电解质不可以用KCl | |
| B. | 导线中通过0.5 mol e-后,向CuSO4溶液中加入12.4g CuCO3,该溶液可恢复原组成 | |
| C. | 闭合K,Pt电极上发生的反应为:4OH--4e-=O2↑+2H2O | |
| D. | 闭合K,整个电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体A的平衡转化率大于气体B平衡转化率 | |
| B. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数减小 | |
| C. | 物质D的聚集状态一定是气体 | |
| D. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃做防火材料 | B. | 二氧化硅不和任何酸反应 | ||
| C. | 可用石英坩埚加热氢氧化钠固体 | D. | 光导纤维的主要成分是硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯与等物质的量氯化氢加成只生成一种产物 | |
| B. | 1mol丙烯完全燃烧的耗氧量为4.5mol | |
| C. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| D. | 1mol丙烯和1mol聚丙烯完全燃烧放出CO2的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com