
【题目】下列关于化学键说法正确的是( )
A. 构成单质分子的微粒中不一定含有化学键
B. 只含有共价键的物质一定是共价化合物
C. NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键
D. CaCl2 中既有共价键又有离子键
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是
A. 任何非金属单质分子中一定含有共价键
B. 离子化合物中可能存在共价键,共价化合物中也可能存在离子键
C. 离子化合物中可能存在共价键,但共价化合物中一定不存在离子键
D. MgF2中既含有离子键又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
t c | 初始 | 2min | 4min | 6min | 8min |
c(A)( mol·L -1) | 2.50 | 2.20 | 2.00 | 2.00 | 2.20 |
c(B)( mol·L -1) | 1.56 | 2.16 | 2.56 | 2.56 | 2.16 |
c(C)( mol·L -1) | 0.39 | 0.54 | 0.64 | 0.64 | 1.54 |
请填空:
(1)前2 min内,v(B)= _______________________。
(2) 到2 min末A 的转化率为_________________。
(3)该反应的化学方程式为_______________________________________。
(4)6 min - 8 min若只改变了反应体系中某一种物质的浓度,则应为_____(填选项字母)
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为________________mol·L -1
(5)如果在相同条件下,若开始加入的三种物质的物质的量浓度是原来的2倍,则_____是原来的2倍。
a. B的平衡浓度 b. 达到平衡的时间 c. 平衡时气体的密度 d. 平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向50mL 0.018mol/L![]() 溶液中加入50mL 0.02mol/L盐酸生成沉淀。已知:
溶液中加入50mL 0.02mol/L盐酸生成沉淀。已知: ![]() ,则生成沉淀后的体系中
,则生成沉淀后的体系中![]() 为(忽略溶液体积变化)
为(忽略溶液体积变化)
A. ![]() mol/L B.
mol/L B. ![]() mol/L
mol/L
C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图转化关系中,A、B、C、D、E都是短周期元素的单质,在常温常压下A是活泼金属,其余都是气体,且C呈黄绿色。化合物H和I两种气体相遇时产生白烟。化合物G的焰色反应为黄色。反应①和②均在溶液中进行。请按要求回答下列问题。

(1)写出下列物质的化学式:D_______、F________、B___________
(2)反应①的离子方程式为________________________________________
(3)向K溶液中加入硝酸酸化的硝酸银溶液,反应的现象为____________
(4)将少量单质C通入盛有淀粉KI溶液的试管中,液体变为蓝色。该反应的离子方程式为__________________________________________________,说明单质C的氧化性_________于单质碘(填“强”或“弱”)。
(5)向J溶液中滴入NaOH溶液时,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色。写出沉淀由灰白色变成红褐色的化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质有关的叙述正确的是
A.苯和乙烯都能使溴水褪色,且反应原理相同
B.乙烯和氯乙烯都可以通过聚合反应得到高分子材料
C.用乙烷或乙烯制备氯乙烷的反应类型完全相同
D.苯甲醇与苯酚均能与Na反应,两者是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废料中主要含有Al2O3、Co2O3CoO、少量Fe3O4等金属氧化物(Co2O3CoO不与强碱反应).实验室科技人员欲将之分离并制备相关物质,设计流程如下: 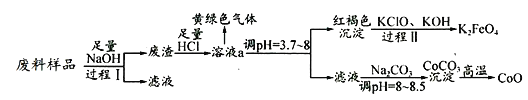
(1)过程Ⅰ中的操作名称是__,写出过程Ⅰ发生反应的化学方程式____________.
(2)溶液a中含有金属离子有 _________________.
(3)溶液a中逸出的黄绿色气体是氯气,下列说法不正确的是_________.
①氯气是有漂白性的酸性气体
②液氯和氯水均为液体,且都含有氯分子
③将氯气通入碱液时,氯气既是氧化剂,又是还原剂
④次氯酸见光易分解,说明次氯酸是弱酸
⑤向氯水中滴硝酸银溶液,有白色沉淀生成,说明氯水中含Cl-
(4)写出过程Ⅱ发生反应的离子方程式:_______________________________.
高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
则充电时阳极反应式为___________________________________.
(5)Co可以形成CoC2O42H2O(M为183g/mol),5.49g该晶体在空气中加热,在不同温度下分别得到一种固体物质,其质量如表:
温度范围(℃) | 固体质量(g) |
150﹣210 | 4.41 |
290﹣320 | 2.41 |
890﹣920 | 2.25 |
经测定,210℃~290℃过程中,产生的气体只有CO2,则此过程发生的化学反应方程式为:______________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. υ(A)=0.5mol/(L·s) B. υ(B)=0.3mol/(L· s) C. υ(C)=0.8mol/(L·s) D. υ(D)=1mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com