
| A. | 0.533L | B. | 0.267L | C. | 4.0L | D. | 2.0L |
分析 根据MgCl2和AlCl3的混合溶液与氢氧化钠溶液的反应可知,要使Mg2+全部转化为沉淀分离出来,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,由钠离子守恒可知:n(NaOH)=n(NaCl)+n(NaAlO2),再根据氯离子、Al元素守恒可计算n(NaOH),进而计算氢氧化钠溶液体积.
解答 解:将200mL MgCl2,AlCl3的混合溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,
溶液中n(Cl-)=0.2L×2mol/L×2+0.2L×3mol/L×3=2.6mol,
溶液中n(AlO2-)=n(Al3+)=0.2L×3mol/L=0.6mol,
由钠离子守恒可知:n(NaOH)=n(NaCl)+n(NaAlO2)=n(Cl-)+n(AlO2-)=2.6mol+0.6mol=3.2mol,
所以至少需要0.8mol/L氢氧化钠溶液的体积为$\frac{3.2mol}{0.8mol/L}$=4L,
故选:C.
点评 本题考查混合物的有关计算,侧重于学生的分析能力和计算能力的考查,难度中等,注意根据守恒法计算.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在地壳中的含量:Al>Fe>Na | |
| B. | 均能与盐酸反应,生成物中金属价态数值:Al>Fe>Na | |
| C. | 钠、铝均能从FeCl3溶液中置换出铁 | |
| D. | 少量金属钠保存在煤油里 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
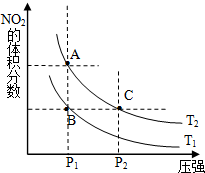 (1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).
(1)对反应N2O4(g)═2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1<T2(填“>”、“<”或“=”);A、C两点的速率VA<VC(同上).| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸电子式 | B. | 核内有8个中子的碳原子${\;}_{6}^{8}$C | ||
| C. | CO2的比例模型 | D. | 纯碱的化学式Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
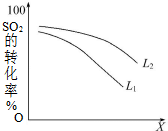 一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1
一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com