
| A、1L 0.1mol/L的碳酸钠溶液中C(Na+):C(CO32-)=2:1 |
| B、25℃时NaOH溶液中水的Kw大于100℃时NaCl溶液中水的Kw |
| C、中和体积相同pH相等的硫酸和醋酸溶液,消耗等物质的量浓度的NaOH溶液的体积:硫酸>醋酸 |
| D、25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c(OH-)=10-6mol?L-1 |


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:


| 时间(min) | 0 | 2 | 4 | 6 | 8 |
| c(HI)mol?L-1 | 8.0 | 5.0 | 3.0 | 2.0 | 2.0 |
| c(H2)mol?L-1 | 0 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取等物质的量的两种金属单质X、Y分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液 | 溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 在CuSO4溶液中加入KI溶液,在加入苯,振荡 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子液体可以作为电池的电解质 |
| B、硝酸乙基铵水溶液呈碱性 |
| C、硝酸乙基铵水解的离子方程式表示为:C2H5NH3++H2O═C2H5NH2+H3O+ |
| D、相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
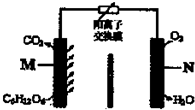 一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )
一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )| A、电池工作时H+从M极区移向N极区 |
| B、N极为正极,发生还原反应 |
| C、M极的电极反应式为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| D、当N极消耗5.6L(标况下)气体时,则有2NA个H+通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与氧气、水等反应时钠均作还原剂,则金属单质参与反应时金属单质均作还原剂 |
| B、铁能从硫酸铜溶液中置换出铜,则钠也能从硫酸铜溶液中置换出铜 |
| C、碳在少量氧气中燃烧生成CO、在过量氧气中燃烧生成CO2,则硫在少量氧气中燃烧生成SO2、在过量氧气中燃烧生成SO3 |
| D、铝粉在氧气中燃烧生成Al2O3,则铁丝在氧气中燃烧生成Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,2.3g金属钠与氧气完全反应失电子数为0.1NA |
| B、常温常压下,氧气和臭氧(O3)的混合物32g中含有NA个氧原子 |
| C、1molOH- 中含有的电子数为9NA |
| D、0.1mol/L硫酸铝溶液中含有硫酸根的个数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com