
【题目】叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
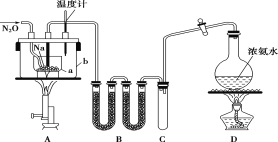
已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为______。
(2)步骤①中先加热通氨气的目的是_______________;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__________;步骤③中最适宜的加热方式为 ______(填“水浴加热”,“油浴加热”)。
(3)生成NaN3的化学方程式为 _______。
(4)图中仪器a用的是铁质而不用玻璃,其主要原因是_____。
(5)步骤④中用乙醚洗涤的主要目的是_______。
(6)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+;试样中NaN3的质量分数为_______。
【答案】碱石灰(或氢氧化钠固体) 排尽装置中的空气防止空气中氧气等与钠发生反应 2Na+2NH3![]() 2NaNH2+H2 油浴加热 NaNH2+N2O
2NaNH2+H2 油浴加热 NaNH2+N2O![]() NaN3+H2O 反应过程中有水生成会与钠生成NaOH能腐蚀玻璃 NaN3不溶于乙醚,能减少NaN3的溶解损耗;且乙醚易挥发,有利于产品快速干燥 93.60%
NaN3+H2O 反应过程中有水生成会与钠生成NaOH能腐蚀玻璃 NaN3不溶于乙醚,能减少NaN3的溶解损耗;且乙醚易挥发,有利于产品快速干燥 93.60%
【解析】
(1)根据已知:NaN3是易溶于水,故制备过程不能有水的参与,据此分析;
(2)反应物钠与空气中二氧化碳和水反应,需排除装置内的空气;氨气与熔化的钠反应生成NaNH2和氢气;步骤③的温度为210~220℃,选择油浴加热;
(3)NaNH2和N2O价态归中得到NaN3,据此书写;
(4)a中有可能生成NaOH,会腐蚀玻璃;
(5)根据“NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚”分析;
(6根据方程式和电子守恒进行计算。
(1)已知:NaN3易溶于水,所以在制备过程不能有水,D中制备的氨气含有水蒸气,用B装置盛放碱石灰(或氢氧化钠固体)干燥氨气;
(2)步骤①中先加热通氨气,排尽装置中的空气,防止空气中的水蒸气和二氧化碳进入与钠反应;氨气与熔化的钠反应生成NaNH2和氢气,反应为:2Na+2NH3![]() 2NaNH2+H2;已知步骤③的温度为210~220℃,故选择油浴加热;
2NaNH2+H2;已知步骤③的温度为210~220℃,故选择油浴加热;
(3)NaNH2和N2O生成NaN3的反应为:NaNH2+N2O![]() NaN3+H2O;
NaN3+H2O;
(4)a中有可能生成NaOH,会腐蚀玻璃,故仪器a用的是铁质而不用玻璃;
(5)由题可知,NaN3不溶于乙醚,能减少NaN3的溶解损耗;且乙醚易挥发,有利于产品快速干燥,故用乙醚洗涤产品;
(6)(NH4)2Ce(NO3)6的总的物质的量n[(NH4)2Ce(NO3)6]=0.1010mol/L×0.050L=0.00505mol,部分与叠氮化钠反应,剩余的(NH4)2Ce(NO3)6用(NH4)2Fe(SO4)2标准溶液滴定,根据已知反应:Ce4++Fe2+=Ce3++Fe3+,参与反应的(NH4)2Ce(NO3)6与标准液的物质的量相等,为:0.0500mol/L×0.0290L=0.00145mol,故与叠氮化钠反应的(NH4)2Ce(NO3)6有0.00505mol-0.00145mol=0.0036mol,根据反应有:NaN3~(NH4)2Ce(NO3)6,则2.500g试样中叠氮化钠的质量为:0.0036mol×65g/mol×![]() =2.34g,所以试样中NaN3的质量分数为
=2.34g,所以试样中NaN3的质量分数为![]() ×100%=93.60%。
×100%=93.60%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是( )
A.用粘土焙烧制的红陶,陶器显红色的原因可能是含有![]()
B.氢氧化铝、小苏打可作胃酸的中和剂
C.烟花中添加了含铁、铂元素的化合物会更加绚丽缤纷
D.水玻璃暴露在空气中会发生变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述不正确的是( )
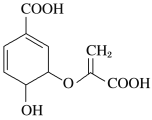
A. 分子中含有4种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1 mol 分枝酸最多可与2 mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeSO4·7H2O ![]() Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
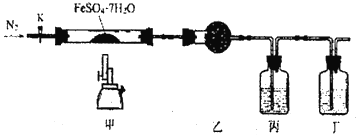
A. 乙、丙、丁中可依改盛装无水CuSO4、Ba(NO3)2溶液、品红溶液
B. 实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将13.6gCu和Cu2O组成的混合物加入250 mL一定浓度的稀硝酸中,固体完全溶解生成Cu(NO3)2和NO。向所得溶液中加入1.0 L 0.5 molL-1的NaOH溶液,生成沉淀的质量为19.6 g,此时溶液呈中性,且金属离子(钠离子除外)沉淀完全。下列说法正确的是( )
A.原固体混合物中,Cu和Cu2O的物质的量之比为1:1
B.原稀硝酸的浓度为2.4 mol·L-1
C.固体溶解后剩余硝酸的物质的量为0.05 mol
D.产生的NO的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下转化关系(其他产物及反应所需条件均已略去)。
![]()
以下推断错误的是
A.当X是盐酸时,则F可能是稀硫酸
B.当X是氢氧化钠时,则D是红棕色气体
C.当X是不论是盐酸还是氢氧化钠时,则F都可能是强酸
D.当X是氢氧化钠时,B跟Cl2反应可能有白烟现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有3.5 mol KNO3和2.2 mol H2SO4,向其中加入1.2 mol Fe,充分反应(已知NO![]() 被还原为NO)。下列说法正确的是
被还原为NO)。下列说法正确的是
A.反应过程中转移的电子数3NA
B.反应后生成NO的体积为24.64 L
C.所得溶液中c(Fe2+)∶c(Fe3+)=1∶3
D.所得溶液中c(NO3-)=2.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X可能含有Na+、Fe3+、Ca2+、SO42-、 CO32- 、Cl-、I-中的几种离子。为确定其组成,设计并完成以下实验:

根据上述实验,以下推测合理的是
A. 溶液X中是否存在Na+还需要通过焰色反应进一步确认
B. 溶液X中一定不含Fe3+、Ca2+、SO42-
C. 为确定溶液X中是否含有Cl-,可取溶液2加入CCl4充分萃取后,再取上层液体加入AgNO3溶液
D. 溶液X的溶质为Na2CO3和NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验的装置、药品、操作和现象的预测中都正确的是( ):
A. 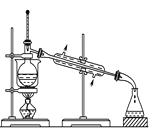 可从含碘的苯溶液里分离出碘单质并回收苯溶剂
可从含碘的苯溶液里分离出碘单质并回收苯溶剂
B. 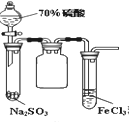 当70%H2SO4跟Na2SO3粉末混合后,可观察到右端试管内出现淡黄色浑浊
当70%H2SO4跟Na2SO3粉末混合后,可观察到右端试管内出现淡黄色浑浊
C. 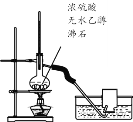 当将烧瓶内液体迅速升温至170℃时,可用排水法收集到乙烯气体
当将烧瓶内液体迅速升温至170℃时,可用排水法收集到乙烯气体
D. 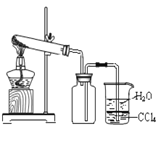 将盛氯化铵和消石灰固体的试管加热,可制取并收集到干燥的NH3
将盛氯化铵和消石灰固体的试管加热,可制取并收集到干燥的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com