

分析 某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,将A溶于水,然后过滤得到沉淀B为Al2O3和Fe2O3,滤液中含有KAl(SO4)2,向沉淀B中加入NaOH溶液,发生反应Al2O3+2OH-=2AlO2-+H2O,过滤得到沉淀C为Fe2O3,滤液中含有AlO2-,向滤液中加入适量稀盐酸,发生反应AlO2-+H2O+H+=Al(OH)3↓,得到的沉淀D为氢氧化铝沉淀,加热发生反应2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,所以固体F是Al2O3;向硫酸铝溶液中加入过量氨水,铝离子和一水合氨反应生成氢氧化铝沉淀D,离子方程式为Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+,滤液E中溶质为NH3﹒H2O、K2SO4、(NH4)2SO4,依据硫酸根离子检验方法设计实验操作检验硫酸根离子的存在,结合题目分析解答.
解答 解:某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,将A溶于水,然后过滤得到沉淀B为Al2O3和Fe2O3,滤液中含有KAl(SO4)2,向沉淀B中加入NaOH溶液,发生反应Al2O3+2OH-=2AlO2-+H2O,过滤得到沉淀C为Fe2O3,滤液中含有AlO2-,向滤液中加入适量稀盐酸,发生反应AlO2-+H2O+H+=Al(OH)3↓,得到的沉淀D为氢氧化铝沉淀,加热发生反应2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,所以固体F是Al2O3;向硫酸铝溶液中加入过量氨水,铝离子和一水合氨反应生成氢氧化铝沉淀D,离子方程式为Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+,滤液E中溶质为NH3﹒H2O、K2SO4、(NH4)2SO4,依据硫酸根离子检验方法设计实验操作检验硫酸根离子的存在,结合题目分析解答;
(1)分离难溶性固体和溶液采用过滤方法,所以Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是过滤,这种方法所用的玻璃仪器中除了烧杯外还需要漏斗、玻璃棒,
故答案为:过滤,玻璃棒、漏斗;
(2)上述分析可知,B为Al2O3和Fe2O3,C为Fe2O3,D为Al(OH)3,
故答案为:Al2O3和Fe2O3,Fe2O3,Al(OH)3;
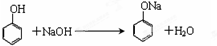
(3)反应①为氧化铝和氢氧化钠的反应,生成偏铝酸钠和水,化学方程式为Al2O3+2NaOH=2NaAlO2+H2O;
反应②为铝离子和一水合氨的反应,生成铵盐和氢氧化铝沉淀,离子方程式为Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O; Al3++3 NH3•H2O=Al(OH)3↓+3 NH4+;
(4)检验溶液E中含有SO42-的操作为取少量溶液E于试管,加入盐酸酸化,再加少量BaCl2,有白色沉淀生成,则说明溶液E含SO42-;
故答案为:取少量溶液E于试管,加入盐酸酸化,再加少量BaCl2,有白色沉淀生成,则说明溶液E含SO42-;
点评 本题考查物质分离和提纯,侧重考查基本操作、物质的性质,为高考常见题型,涉及离子方程式的书写、分离方法的选取、物质成分判断,明确物质性质是解本题关键,注意氢氧化铝和氧化铝的两性,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CHCl3的碳原子总数为0.1 NA | |
| B. | 1 mol甲醇中含有C-H键的数目为4NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读下列实验内容,根据题目要求回答问题:
阅读下列实验内容,根据题目要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 1 | 实验步骤 | 实验现象 |
| ⅰ.取2mL 1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液3滴(1滴约为0.05mL,下同). | ⅰ.溶液呈棕黄色. | |
| ⅱ.向其中滴加2滴0.1mol•L-1 KSCN溶液. | ⅱ.溶液不显红色. |
| 实验 2 | 实验步骤 | 实验现象 |
| ⅰ.取2mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液3滴. | ⅰ.溶液呈棕黄色. | |
| ⅱ.向其中滴加2滴0.1mol•L-1 KSCN溶液. | ⅱ.溶液显红色. | |
| ⅲ.继续加入2mL CCl4,充分振荡、静置. | ⅲ.液体分层,上层红色消失,变为棕黄色,下层呈紫红色. |
| 实验3 | 实验步骤 | 实验现象 |
| ⅰ.取1mL实验2中棕黄色的上层清液,再加入2mL CCl4,振荡、静置. | ⅰ.液体分层,上层呈黄色,下层呈紫红色. | |
| ⅱ.取1mL饱和碘水,加入2mL CCl4,振荡、静置. | ⅱ.液体分层,上层为无色,下层呈紫红色. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置,验证CO2的性质.
利用如图装置,验证CO2的性质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶内壁沾有水滴没有烘干就进行配制 | |
| B. | 转移液体时有少量洒落 | |
| C. | 量取浓硫酸时仰视刻度线 | |
| D. | 定容摇匀后液面下降再加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com