
【题目】A、B、C、D、E五种短周期主族元素的原子序数依次增大,已知:
①其原子半径大小关系是D>E>B>C>A;
②A、D同主族,B、C、E分处三个连续的主族,且最外层电子数依次增加;
③C是地壳中含量最多的元素,D与C可形成原子个数比为1∶1或2∶1的化合物。
请填写以下空白:
(1)化合物D2C2的电子式为________________。
(2)用电子式表示D2C的形成过程:_______________________。
(3)单质A和单质B在一定条件下发生反应的化学方程式为____________________。
(4)单质E与A、C、D三种元素形成的化合物发生反应的化学方程式为_________。
【答案】![]()
![]() N2+3H2
N2+3H2![]() 2NH3 Cl2+2NaOH=NaClO+NaCl+H2O
2NH3 Cl2+2NaOH=NaClO+NaCl+H2O
【解析】
A、B、C、D、E五种短周期主族元素的原子序数依次增大,已知:原子半径大小关系是:D>E>B>C>A,C是地壳中含量最多的元素,则C为O元素;A、D同主族,则A为H元素,D为Na元素;结合原子半径大小关系可知:D与E位于第三周期、B与C位于第二周期,B、C、E分处三个连续的主族,且最外层电子数依次增加,则B为N元素、E为Cl元素;D与C可形成原子个数比为1:1的化合物为Na2O2,形成的2:1的化合物为Na2O,据此进行解答。
根据上述分析可知:A是H,B是N,C是O,D是Na,E是Cl元素,D与C可形成原子个数比为1:1的化合物为Na2O2,形成的2:1的化合物为Na2O。
(1)化合物D2C2是Na2O2,该物质是离子化合物,2个Na+与O22-通过离子键结合,O22-中2个O原子之间通过非极性共价键结合,其电子式为![]() ;
;
(2)D2C是Na2O,该物质是离子化合物,2个Na+与O2-通过离子键结合,用电子式表示其形成过程为:![]() ;
;
(3) A是H元素,B是N元素,H2与N2在高温、高压、催化剂条件下反应产生NH3,该反应是可逆反应,反应物不能完全转化为生成物,用化学方程式表示为:N2+3H2![]() 2NH3;
2NH3;
(4)E是 Cl元素,A、C、D三种元素形成的化合物是NaOH,Cl2与NaOH在溶液中发生反应产生NaCl、NaClO和水,反应方程式为:Cl2+2NaOH=NaClO+NaCl+H2O。


科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是( )
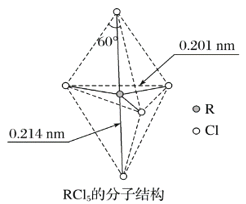
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D. 分子中5个R—Cl键键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______。用O2表示从0~2s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )

A.在NaCl晶体中,距Na+最近的Cl-有6个
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,最小的环上有6个C原子
D.该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称是_______,B含有的官能团是_______________。
(2)①的反应类型是____________,⑦的反应类型是________________。
(3)C和D的结构简式分别为______________、_________________。
(4)异戊二烯分子中最多有________个原子共平面,顺式聚异戊二烯的结构简式为___________。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体__________(填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称 、 。
(2)B位于元素周期表中第 周期第 族。
(3)C的原子结构示意图为 。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第IIA族元素在地壳内蕴藏较丰富,其单质和化合物用途广泛。回答下列问题:
(1)基态Ca原子M能层有_______个运动状态不同的电子,Mn和Ca属于同一周期,且核外最外层电子构型相同,但金属Mn的熔沸点等都比金属Ca高,原因______。
(2)氯气与熟石灰反应制漂白粉时会生成副产物Ca(ClO3)2,Ca(ClO3)2中的阴离子空间构型是_________,中心原子的杂化方式为_______。
(3)碳酸盐的热分解示意图如下图所示。热分解温度:CaCO3__________(填“高于”或“低于”)SrCO3,原因是_______。从成键轨道看,CO2分子内的化学键类型有________。
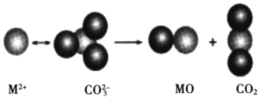
(4)格氏试剂RMgX是镁和卤代烃反应的产物,它在醚的稀溶液中以单体形式存在,在浓溶液中以二聚体存在,二聚体结构如下图所示。请在图中标出二聚体中的配位键__________。
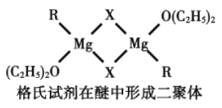
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系不正确的是( )
A.等物质的量的物质燃烧耗O2量:乙烷>乙烯=乙醇>乙炔
B.熔点:MgO>CaO>硫磺>Br2
C.下列物质的稳定性:H2O>H2S>H2Se
D.电负性:N>O>Si>Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() ,为研究影响该反应速率的因素,在不同条件下进行4组实验,Y、Z的起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。下列说法不正确的是( )
,为研究影响该反应速率的因素,在不同条件下进行4组实验,Y、Z的起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。下列说法不正确的是( )
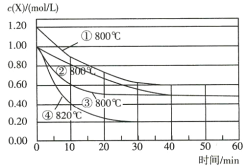
A.若实验②、④只改变一个条件,则由实验②、④得出结论:升高温度,化学反应速率加快
B.若实验①、②只改变一个条件,则由实验①、②得出结论:增大反应物浓度,化学反应速率加快
C.若实验②、③只改变一个条件,则实验③使用了催化剂
D.0~10min内,实验③的平均速率v(Y)=0.04 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com