
| A. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| C. | 硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag↓ | |
| D. | 盐酸跟氢氧化镁反应:H++OH-═H2O |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除水垢 | |
| B. | 甘油加水作护肤剂 | |
| C. | 双氧水漂白美容 | |
| D. | 烹鱼时,加入少量的料酒和食醋可减少腥味,增加香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol葡萄糖可水解生成2mol乳酸(C3H6O3) | |
| B. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| C. | 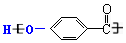 nOH的结构中含有酯基 nOH的结构中含有酯基 | |
| D. | 油脂和蛋白质都是能发生水解反应的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3-、CO32- | B. | Ag+、K+、Cl-、NO3- | ||
| C. | Cu2+、SO42-、Na+、CO32- | D. | Ba2+、OH-、Mg2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
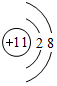 .
.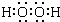
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)=CO2(g)+4H2O(g)△H=-890 kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890 kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-445 kJ/mol | |
| D. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com