
| A. | 10L | B. | 15L | C. | 25L | D. | 27L |
分析 先写出三种烃燃烧的化学方程式,然后分析反应恰好气体体积变化(在120℃时生成的水为气态),然后利用极值法结合各燃烧方程式判断反应后气体总体积的范围即可.
解答 解:在120℃时生成的水为气态,且氧气过量,根据燃烧方程式C2H4+3O2$\stackrel{点燃}{→}$2CO2+2H2O、2C2H2+5O2$\stackrel{点燃}{→}$4CO2+2H2O、2C2H6+7O2$\stackrel{点燃}{→}$4CO2+6H2O可知,①当混合气体完全为乙烯和氧气时,反应恰好气体总体积不变,仍然为25L;
②当混合气体完全为乙炔和氧气时,反应后气体体积减小,当二者恰好反应时,得到气体体积最小,此时乙炔体积为:25L×$\frac{2}{2+7}$=$\frac{50}{7}$L,
根据反应2C2H2+5O2$\stackrel{点燃}{→}$4CO2+2H2O可知,反应后气体总体积为:25L×$\frac{6}{7}$=$\frac{150}{7}$=21$\frac{3}{7}$≈21.4L;
③当混合气体完全为乙烷和氧气时,反应后气体总体积变大,当二者恰好反应时,生成气体体积最大,根据反应2C2H6+7O2$\stackrel{点燃}{→}$4CO2+6H2O可知,混合气体最大体积为:25L×$\frac{10}{9}$≈27.8L,
根据分析可知,最终得到气体体积范围为:21.4L<V<27.8L,
故选CD.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握极值法在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤法 | B. | 萃取法 | C. | 分液法 | D. | 蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取
(1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取| 元 素 | X | Y | Z |
| 电 负 性 | 1.5 | 1.2 | 1.8 |
| 第一电离能/kJ•mol-1 | 578 | 738 | 787 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH大小顺序①>④>③>② | |
| B. | C(NH3•H2O)大小顺序:②>④>③>① | |
| C. | 混合溶液④中存在C(NH3•H2O)+C(CO32-)+C(H+)=C(OH-)+C(H2CO3) | |
| D. | 混合溶液③中水的电离被促进,其中C(H+)和C(OH-)均大于1.0×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
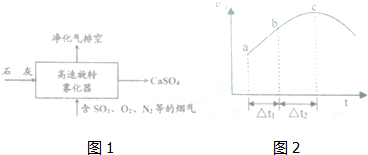
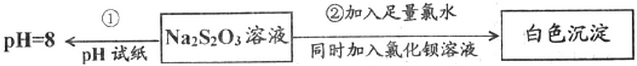
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
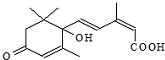
| A. | 分子式C15H21O4 | |
| B. | 既能发生加聚反应,又能发生缩聚反应 | |
| C. | 分子中有三种官能团 | |
| D. | 既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②③⑧ | C. | ③④⑤⑦⑧ | D. | ②⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com