
| A. | 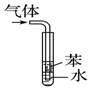 吸收氨气,并防止倒吸 | B. | 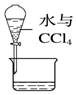 分离水和CCl4 | ||
| C. | 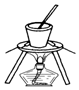 从食盐水中提取NaCl | D. | 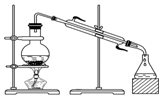 石油的分馏 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同 | |
| B. | 若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4 | |
| C. | 若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m | |
| D. | Mm+离子一定不能与酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
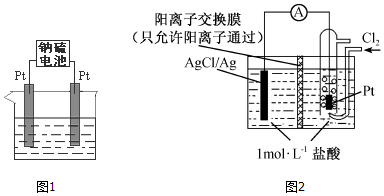
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为118 | B. | 中子数为179 | C. | 质子数为118 | D. | 电子数为118 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂只有硝酸钾 | |
| B. | C即是氧化剂也是还原剂 | |
| C. | 被氧化与被还原的S的质量之比为3:2 | |
| D. | 还原产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | W、Y、X三种元素的原子半径依次减小 | |
| B. | Z元素的气态氢化物的热稳定性比Y的高 | |
| C. | W元素与氢元素可能会形成W2H6 | |
| D. | Y元素的单质能从NaZ溶液中置换出Z元素的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com