
【题目】烟气中SO2和NOx(NO及NO2)的脱除对于环境保护意义重大。
(1)湿式氨法烟气脱硫脱氮是通过氨水吸收烟气,得到含NH4+、SO32-、SO42-、HSO3-、和NO2-的吸收液。
① 用离子方程式解释吸收液中含有SO32-的原因:_______________。
② 吸收液中的SO32-、HSO3-均对NO2具有吸收作用,但HSO3-对NO2的吸收能力比SO32-弱。
a. SO32-与NO2反应生成NO2-的离子方程式是_______________________。
b. 经测定,在烟气的吸收过程中,吸收液对NO2的吸收率随烟气通入量变化的曲线如下图所示。

结合化学用语解释产生上述结果的原因:_____________。
(2)二氧化氯(ClO2)具有很强的氧化性,可用于烟气中SO2和NO的脱除。
① 酸性条件下,电解NaClO3溶液,生成ClO2的电极反应式是__________。
② 研究表明:ClO2氧化SO2和NO的反应历程与下列反应有关。
i.NO + ClO2 === NO2+ ClO
ii.NO + ClO === NO2 + Cl
iii.SO2 + ClO2 === SO3+ ClO
iv.SO2 + ClO === SO3 + Cl
实验测得:ClO2分别氧化纯SO2和纯NO的氧化率以及ClO2氧化SO2和NO混合气中的SO2氧化率随时间的变化情况如下图所示。

a. 结合上述信息,下列推论合理的是________(填字母序号)。
A. NO的存在会影响ClO2氧化SO2的反应速率
B. ClO2氧化SO2的反应速率慢于ClO2氧化NO的反应速率
C. 反应i中生成的NO2可以加快ClO2氧化SO2的反应速率
b. 结合反应历程,分析混合气中SO2氧化速率较纯SO2氧化速率快的可能原因是_____。
【答案】 SO2 + 2NH3·H2O === SO32- + 2NH4+ + H2O 2NO2 + SO32- + 2OH- === 2NO2- + SO42- + H2O SO2 + SO32- + H2O === 2HSO3-,随着烟气通入量的增加,吸收液中c(HSO3-)增大,c(SO32-)减小,导致吸收液对NO2的吸收能力下降 ClO3- + 2H+ + e- === ClO2 + H2O AB 因ClO2氧化NO的反应速率较快,故当SO2中混有NO时,ClO2氧化NO生成的ClO会继续氧化SO2,即随ClO浓度的增加,氧化混合气中SO2的氧化速率增大
【解析】试题分析:(1)①SO2与氨水反应生成亚硫酸铵。
② 吸收液中的SO32-、HSO3-均对NO2具有吸收作用,但HSO3-对NO2的吸收能力比SO32-弱。
a. SO32-与NO2发生氧化还原反应生成NO2-和SO42-。
b. 随着烟气通入量的增加,吸收液中c(HSO3-)增大,c(SO32-)减小。
(2)① 酸性条件下,电解ClO3-在阴极得电子发生还原反应生成ClO2。
②a A. 根据图示,混合气体中ClO2氧化SO2的反应速率加快
B. 根据图示,ClO2氧化SO2的反应速率慢于ClO2氧化NO的反应速率
C. 反应i中生成的ClO可以加快氧化SO2的反应速率;
b. ClO2氧化NO的反应速率较快,故当SO2中混有NO时,ClO2氧化NO生成的 ClO会继续氧化SO2
解析:(1)①SO2与氨水反应生成亚硫酸铵,反应离子方程式为SO2 + 2NH3·H2O === SO32- + 2NH4+ + H2O。
②a. 根据氧化还原反应规律,SO32-与NO2发生氧化还原反应生成NO2-和SO42-,反应离子方程式为2NO2 + SO32- + 2OH- === 2NO2- + SO42- + H2O。
b. SO2 + SO32- + H2O === 2HSO3-,随着烟气通入量的增加,吸收液中c(HSO3-)增大,c(SO32-)减小,导致吸收液对NO2的吸收能力下降。
(2)① 酸性条件下,电解ClO3-在阴极得电子发生还原反应生成ClO2,阴极电极反应为ClO3- + 2H+ + e- === ClO2 + H2O。
② a.根据图示,混合气体中ClO2氧化SO2的反应速率加快,故A正确;根据图示,ClO2氧化SO2的反应速率慢于ClO2氧化NO的反应速率,故B正确 ;反应i中生成的ClO可以加快氧化SO2的反应速率,故C错误;
b. ClO2氧化NO的反应速率较快,故当SO2中混有NO时,ClO2氧化NO生成的 ClO会继续氧化SO2,即随ClO浓度的增加,氧化混合气中SO2的氧化速率增大


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离( )
A. 苯和水 B. 乙酸乙酯和乙酸
C. 食盐水和泥沙 D. 硝酸钾和硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得),若1 mol水蒸气转化为液态水放出的热量为45kJ,则反应H2(g) +![]() O2(g) = H2O( l )的ΔH =________________kJ/mol。
O2(g) = H2O( l )的ΔH =________________kJ/mol。
(2)下图为氢氧燃料电池的结构示意图,当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:

①图中通过负载的电子流动方向_______ (填“向左”或“向右”). 负极发生_____________反应;
②写出氢氧燃料电池工作时电极反应式负极:________________________________,正极:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. N和As属于第ⅤA族元素,氮原子得电子能力比砷原子强
B. 族序数等于其周期序数的元素一定是金属元素
C. 元素周期表中,位于金属和非金属交界线附近的元素属于过渡元素
D. Si、S、Cl的最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
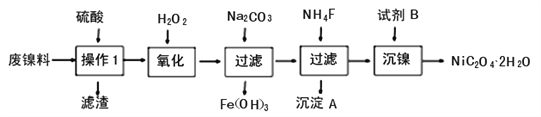
(1)操作1的名称为________________。
(2)沉淀A为______________________________(用电子式表示)。
(3)试剂B的名称为____________________________,沉镍后,滤液中C2O42-的浓度为0.01mol/L,则残留在滤液中的 c(Ni2+)=_______________(已知Ksp[NiC2O4]= 4×10-10)。
(4)NiC2O4·2H2O 高温煅烧制取三氧化二镍的热重曲线如图所示:

①T3温度后,草酸镍全部转化为三氧化二镍,则a为____________(保留一位小数)。
②T2温度发生反应的化学方程式为________________________。
(5)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体![]() 现象
现象![]() 澄清石灰水变浑浊
澄清石灰水变浑浊
①试剂1的化学式为____________________。
②碱石灰的作用是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是
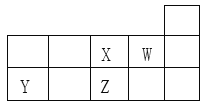
A. Y、Z、X三种元素的原子半径依次增大
B. X、Z都是第2周期VIA族元素,单质的氧化性X>Z
C. Y的气态氢化物的热稳定性比Z的高
D. R元素与W同族且相邻周期,则R元素最高价氧化物的水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或应用的说法不正确的是
A. 二氧化硅是生产光纤制品的基本原料
B. 水玻璃可用于生产黏合剂和防火剂
C. 盐析可提纯蛋白质并保持其生理活性
D. 石油分馏可获得乙烯、丙烯和丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:


(1)常温下含碳量最高的气态烃是________(填字母)。
(2) E的一氯取代物同分异构有_______种。
(3)一卤代物种类最多的是________(填写字母)。
(4) 能够发生加成反应的烃有________(填写字母)。
(5)写出C的加聚反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三酸两碱”是最重要的无机化工产品,广泛用于化学、国防、石油、纺织、冶金、食品等工业。“三酸”是指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。回答下列问题:
(1)浓硝酸不稳定,易分解,需要保存在棕色细口瓶,并用________(填“玻璃”或“橡胶”)塞盖好,该分解的化学方程式为_______________________。
(2)将红热的木炭投入热的浓硝酸中,看到的现象是______________________。写出该反应的化学方程式______________________________。
(3)写出氨水与稀盐酸反应的离子方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com