
【题目】丁烷催化裂化,其碳链按两种方式断裂,生成两种烷烃和两种烯烃。若丁烷的裂化率为90%,且裂化后两种烯烃的质量相等,则裂化后得到的相对分子质量最小的气态烃在混合烃中的体积分数为 ( )
A. 11% B. 19% C. 40% D. 50%
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的氯化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)请写出Fe与水蒸气反应的化学方程式:_____________。
(2)在实验室中,FeCl2可用铁粉和______(填名称)反应制备。
(3)Fe3O4可用多种方法制得,其中由一种单质和一种化合物通过化合反应制备的化学方程式为______。
(4)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:_________________。
(5)现有一含有FeCl2 和FeCl3的混合物样品,实验测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为_________。
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:某废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:
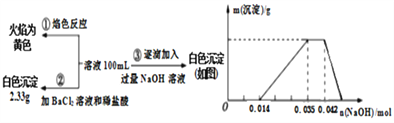
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是______________,一定存在的阳离子是______________________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:_____________________________________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为________,所得沉淀的最大质量是____g。
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L-1,c(NO3-)=____________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液化气的主要成分是丙烷,下列有关丙烷的叙述不正确的是( )
A.是直链烃,但分子中3个碳原子不在一条直线上
B.在光照条件下能够与氯气发生取代反应
C.丙烷比丁烷沸点高
D.1 mol丙烷完全燃烧消耗5 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 欲使1.6 g氧化铁完全被还原,需要CO的体积为672 mL
B. 直接加热CuO可以得到Cu单质
C. 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e-
D. 工业上用电解法制铝,加入冰晶石是为了使氧化铝熔化的温度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,科学家通过粒子加速器进行了一周的实验,获得了6个非常罕见的![]() 原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题:
原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题:
(1) ![]() 原子的核内中子数为________,该原子的核外电子数为________。
原子的核内中子数为________,该原子的核外电子数为________。
(2)以下关于![]() 的叙述正确的是________(填字母序号)。
的叙述正确的是________(填字母序号)。
A. ![]() 与
与![]() 是两种核素
是两种核素
B.科学家获得了一种新元素
C. ![]() 的衰变不是化学变化
的衰变不是化学变化
D.这种铁原子衰变放出两个质子后变成![]()
(3)某同学认为![]() 在一定条件下也可与氧气反应,他的判断依据是___________________________。
在一定条件下也可与氧气反应,他的判断依据是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。实验室提取碘的途径如下所示:
![]()
(1)碘元素在海水中以________存在(填“游离态”或“化合态”)。
(2)灼烧过程中用到的实验仪器有铁三角架、酒精灯、______、_____、______。
(3)操作①中需用到玻璃棒,则玻璃棒的作用是_______________。
(4)向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为________。
(5)操作③是分液,则操作②是___________;操作④是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答:
(1)乙烯的电子式为____________,结构简式为__________________。
(2)下列可以鉴别甲烷和乙烯的试剂为______(填选项字母)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是________(填选项字母)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)已知:2CH3CHO+O2![]() 2CH3COOH,以乙烯为主要原料合成乙酸,合成路线如下图所示:
2CH3COOH,以乙烯为主要原料合成乙酸,合成路线如下图所示:
![]() ①,A
①,A![]() B
B![]()
![]()
反应③的反应类型为__________________反应,反应②的化学方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是

A. 甲一定是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 庚的最高价氧化物水化物酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com