
在下列变化①工业制盐酸 ②工业制漂粉精 ③实验室制氯气中,按氯元素被氧化、被还原、既被氧化又被还原的顺序排列,正确的是
A.①②③ B.②①③ C.③①② D. ①③②
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源:2015-2016学年山西省高一上第一次月考化学试卷(解析版) 题型:选择题
20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法中不正确的是
A.25℃时,饱和KCl溶液的浓度大于4.0mol·L-1
B.此溶液中KCl的质量分数为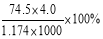
C.20℃时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g·cm-3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省许昌、襄城、长葛三校高一上期中测试化学试卷(解析版) 题型:选择题
标准状况下,现有①6.72 L CH4 ②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 molNH3,对这四种气体的氢原子个数由大到小的顺序排列正确的是
A.②>③>①>④ B.②>③>④>①
C.①>④>②>③ D.①>③>④>②
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中测试理综化学试卷(解析版) 题型:实验题
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
MnO2熔融氧化:3MnO2+ KClO3+ 6KOH  3K2MnO4+ KCl+3H2O ;
3K2MnO4+ KCl+3H2O ;
K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3 。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在 中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④钨坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。

①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A, 打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞 ,打开旋塞 ,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②通入CO2后,用玻璃棒蘸取溶液点在滤纸上,观察到 证明歧化反应已发生。
(3)将三颈烧瓶中所得产物进行过滤,将滤液倒入蒸发皿中,蒸发浓缩,自然冷却结晶,过滤,得到针状的高锰酸钾晶体。本实验应采用低温烘干的方法来干燥产品,原因是___________。
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用滴定管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为 (保留3位有效数字,已知M(KMnO4)=158g·mol-1)。若量取待测液的滴定管用蒸馏水洗净后没有用待测液润洗或烘干,则最终测定结果将 。(填“偏大”、“偏小”、“不变”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二上学期第一次月考化学试卷(解析版) 题型:选择题
下表是几种电解质的电离常数(25℃)
 电解质的强弱判断正确的是
电解质的强弱判断正确的是
A.e最弱
B.b最强
C.由强到弱的顺序为a> b> d >e >c
D.无法确定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为
A.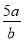 mol/L B.
mol/L B.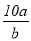 mol/L C.
mol/L C. mol/L D.
mol/L D. mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期第一次月考化学试卷(解析版) 题型:实验题
人体血液里Ca2+离子的浓度一般采用g/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
【配制KMnO4标准溶液】下图是配制50mLKMnO4标准溶液的过程示意图。
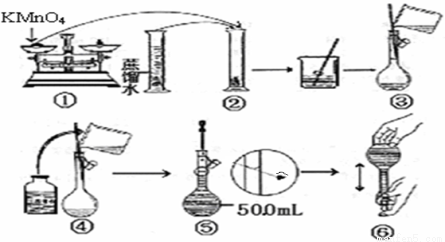
(1)上述过程中有两处错误,请你观察图示,判断其中不正确的操作是(填序号)____________;
(2)如果按照图示的操作配制溶液,所得的实验结果将____________(填偏大或偏小)。
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)滴定时,盛放高锰酸钾器名称为________________,确定反应达到终点的现象________________。
(4)草酸跟酸性KMnO4溶液反应的离子方程式为:_______________________。
(5)根据所给数据计算血液样品中Ca2+离子的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省襄阳市高三上学期期中测试化学试卷(解析版) 题型:选择题
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:

下列说法正确的是
A.气体A是NO2
B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是 A13+和C1―
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com