
����Ŀ��������ʵ��д�����з�Ӧ���Ȼ�ѧ����ʽ��
��1�����飨SiH4����һ����ɫ���壬���������ܷ�����ը����ȼ������SiO2��Һ̬ˮ����֪������1 g������ȼ�ų�����44.6 kJ�����Ȼ�ѧ����ʽ___________________��
��2��13 g C2H2��g����ȫȼ������CO2��H2O��l��ʱ���ų�659 kJ���������÷�Ӧ���Ȼ�ѧ����ʽΪ ___________________��
��3��2.3 gijҺ̬�л����һ������������ϵ�ȼ��ǡ����ȫȼ�գ�����2.7 gˮ��2.24 L CO2����״���������ų�68.35 kJ����������÷�Ӧ���Ȼ�ѧ����ʽΪ ______________��
��4����˹�����������Ϳ�ѧ�о����к���Ҫ�����塣��Щ��Ӧ�ķ�Ӧ����Ȼ��ֱ�Ӳ�ã�����ͨ����ӵķ����ⶨ���ָ�������3���Ȼ�ѧ��Ӧ����ʽ��
Fe2O3��s��+3CO��g��= 2Fe��s��+3CO2��g�� ��H��-24.8 kJ��mol-1
3Fe2O3��s��+ CO��g��=2Fe3O4��s��+ CO2��g�� ��H��-47.2 kJ��mol-1
Fe3O4��s��+CO��g��=3FeO��s��+CO2��g�� ��H��+640.5 kJ��mol-1
д��CO���廹ԭFeO����õ�Fe�����CO2������Ȼ�ѧ��Ӧ����ʽ��_________________��
���𰸡�SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ��H=-1427.2 kJ��mol-1 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ��H=-2636 kJ��mol-1 C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l) ��H=-1367 kJ��mol-1 CO(g)+FeO(s)= Fe(s)+CO2(g) ��H���D218.0 kJ��mol-1
��������
��1������n=![]() �������ʵ�������������1mol����ȼ�շų�����������д���Ȼ�ѧ����ʽ��
�������ʵ�������������1mol����ȼ�շų�����������д���Ȼ�ѧ����ʽ��
��2��ȼ������1mol��ȼ����ȫȼ�������ȶ�������ʱ�ų�������������13g��Ȳȼ������CO2��Һ̬ˮʱ����659kJ������1mol��Ȳȼ�շų�����������ϻ�ѧ����ʽ��д�Ȼ�ѧ����ʽ��ע�����ʵľۼ�״̬�ͷ�Ӧ�ȵĵ�λ�����⣻
��3��2.3gijҺ̬�л����һ������������ϵ�ȼ��ǡ����ȫȼ�գ�����2.7gˮ���ʵ���=![]() =0.15mol��2.24L CO2����״�������ʵ���=
=0.15mol��2.24L CO2����״�������ʵ���=![]() =0.1mol��n��C��=0.1mol��n��H��=0.3mol��n��O��=
=0.1mol��n��C��=0.1mol��n��H��=0.3mol��n��O��=![]() =0.05mol��n��C����n��H����n��O��=0.1mol��0.3mol��0.05mol=2��6��1����ѧʽΪC2H6O�����ʵ���Ϊ0.05mol�����ų�68.35kJ������1mol�л���ȼ�շ���1367kJ���ɴ���д�Ȼ�ѧ����ʽ��
=0.05mol��n��C����n��H����n��O��=0.1mol��0.3mol��0.05mol=2��6��1����ѧʽΪC2H6O�����ʵ���Ϊ0.05mol�����ų�68.35kJ������1mol�л���ȼ�շ���1367kJ���ɴ���д�Ȼ�ѧ����ʽ��
��4�����ݸ�˹���ɷ������㡣
(1)1g��������ʵ���Ϊ��n=![]() =
=![]() mol����1mol����ȼ�շų��ķ�Ӧ��Ϊ
mol����1mol����ȼ�շų��ķ�Ӧ��Ϊ =1427.2kJ/mol��
=1427.2kJ/mol��
���Ը÷�Ӧ���Ȼ�ѧ����ʽΪ��SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ��H=-1427.2 kJ��mol-1��
(2)1mol��ȲΪ26g����25�桢101kPa�£�13g��0.5mol����Ȳȼ������CO2��Һ̬ˮʱ����659kJ����2mol��Ȳȼ������CO2��Һ̬ˮʱ����659kJ��4=2636kJ�������Ȼ�ѧ����ʽΪ��2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ��H=-2636 kJ��mol-1��
��3��2.3gijҺ̬�л����һ������������ϵ�ȼ��ǡ����ȫȼ�գ�����2.7gˮ���ʵ���=![]() =0.15mol��2.24LCO2(��״��)���ʵ���=
=0.15mol��2.24LCO2(��״��)���ʵ���=![]() =0.1mol��n(C)=0.1mol��n(H)=0.3mol��n(O)=
=0.1mol��n(C)=0.1mol��n(H)=0.3mol��n(O)= ![]() =0.05mol��n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6;1����ѧʽΪC2H6O�����ʵ���Ϊ0.05mol�����ų�68.35kJ������1mol�л���ȼ�շ���1367kJ���Ȼ�ѧ����ʽΪ��C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l) ��H=-1367 kJ��mol-1��
=0.05mol��n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6;1����ѧʽΪC2H6O�����ʵ���Ϊ0.05mol�����ų�68.35kJ������1mol�л���ȼ�շ���1367kJ���Ȼ�ѧ����ʽΪ��C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l) ��H=-1367 kJ��mol-1��
��4��Fe2O3��s��+3CO��g��= 2Fe��s��+3CO2��g�� ��H���D24.8kJ��mol ��
3Fe2O3��s��+ CO��g��=2Fe3O4��s��+ CO2��g�� ��H���D47.2kJ��mol ��
Fe3O4��s��+CO��g��=3FeO��s��+CO2��g�� ��H�� +640.5kJ��mol ��
���ݸ�˹���ɿ�֪����3������2��
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g) ��H=(24.8 kJ��mol-1)��3(47.2 kJ��mol-1)(+640.5 kJ��mol-1)��2=1308.0 kJ��mol-1��
�� CO(g)+FeO(s)=Fe(s)+CO2(g) ��H=218.0 kJ��mol-1
�ʴ�Ϊ��CO(g)+FeO(s)= Fe(s)+CO2(g) ��H��-218.0 kJ��mol-1��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѱ���Ϊ����ʮһ���ͽ���������ҵ�����������Ʊ������ѵĹ����������£�
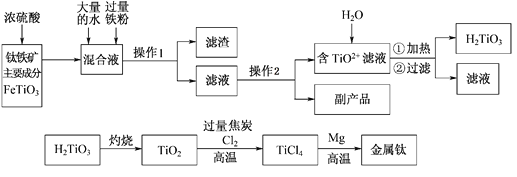
��֪����������Ҫ�ɷ���Ũ���ᷴӦ����Ҫ������TiOSO4��FeSO4��TiOSO4��ˮ��ˮ�⡣��ش��������⣺
��1������1�õ��IJ����������ձ����________________________��
��2�����ϻ�ѧ������ͽ�TiO2+ת��ΪH2TiO3��ԭ��_____________________��
��3����֪�ѵĻ�ԭ�Խ�������п֮�䡣����ɴ�Na��Zn��Fe���ֽ�����ѡһ�ֽ������������е�þ����ô�ý��������Ȼ��ѷ�Ӧ�Ļ�ѧ����ʽ��___________________________________��
��4�����TiO2�����Ti����TiO2��������ʯīΪ����������CaOΪ����ʣ���̼�������ۣ���������Ӧ�ĵ缫��Ӧʽ��_____________________________________��
��5��Ϊ�ⶨ��Һ��TiOSO4�ĺ�������ȡ������Һ10 mL��ˮϡ����100 mL���ӹ������ۣ������ʹ����ȫ��Ӧ��3TiO2+ +Al+6H+=3Ti3++Al3++3H2O�����˺�ȡ��ɫ��Һ20.00 mL�������еμ�2��3��KSCN��Һ��ָʾ������______________________����һ�ֲ������������ƣ��μ�0.1000mol��L-1 FeCl3��Һ������Ti3++Fe3+=Ti4++Fe2+���ζ��յ�ʱ��������________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�CO2���ۺ����öԴٽ�����̼�������ķ�չ����Ҫ���塣
(1)��ҵ����CO2��NH3Ϊԭ����������[CO(NH2)2]����Ӧʵ��Ϊ�������У�
I��2NH3(g)+CO2(g)![]() H2NCOONH4(s) ��H1=-272kJ��mol-1
H2NCOONH4(s) ��H1=-272kJ��mol-1
II��H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) ��H2=+138kJ��mol-1
CO(NH2)2(s)+H2O(g) ��H2=+138kJ��mol-1
��֪��H2O(l)==H2O(g) ��H3=+44kJ��mol-1
����д����NH3��CO2Ϊԭ�ϣ��ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ______________��
��T1��ʱ����1L���ܱ������г���CO2��NH3ģ�ҵ������n(NH3)/n(CO2)=x����ͼ��CO2ƽ��ת����(![]() )��x�Ĺ�ϵ����ͼ��A��NH3��ƽ��ת����
)��x�Ĺ�ϵ����ͼ��A��NH3��ƽ��ת����![]() =________����
=________����

�۵�x=1.0ʱ������ʼ��ѹǿΪp0kPa��ˮΪҺ̬��ƽ��ʱѹǿ��Ϊ��ʼ��1/2����÷�Ӧ��ƽ�ⳣ��Kp=_______(kPa)-3(KPΪ�Է�ѹ��ʾ��ƽ�ⳣ��)��
(2)��CO2��H2�ϳɼ״���3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)��H=��49.0kJ��mol-1����T��ʱ���ס��ҡ�������2L�ĺ����ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ƽ��ʱ�й��������£�
CH3OH(g)+H2O(g)��H=��49.0kJ��mol-1����T��ʱ���ס��ҡ�������2L�ĺ����ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ƽ��ʱ�й��������£�

�ټ�����10s�ﵽƽ��ʱ���x=39.2�������CO2��ƽ����Ӧ����____________��
������˵����ȷ����________(����ĸ���)��
A��2c1<c3 B��z<2y C��p3>2p2 D����1+��3>1
(3)��NaOH��Һ��̼�����ɻ�û�����ƷNa2CO3����������ij�β���õ�pH=10����Һ������Һ��c(CO32-)��c(HCO3-)=_____[K1(H2CO3)=4.4��10-7��K2(H2CO3)=5��10-11]����Һ��c(Na+)_____c(HCO3-)+2c(CO32-)(����>����=����������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
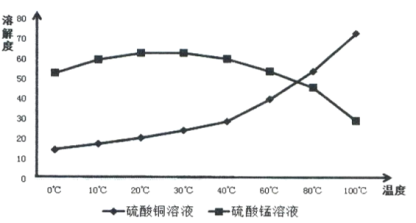
����Ŀ����ͭ����Ҫ�ɷ�ΪCu2S�����̿���Ҫ�ɷ�MnO2�����Ƕ���������Fe2O3��SiO2�����ʡ���ҵ���ۺ����������ֿ����Ʊ�����ͭ�������̺����ʵ���Ҫ�����������£�

��1����ȡ2�������¶ȿ�����500C��600C֮���ԭ����__________________��
��2�������ȡʱ��Fe3+��MnO2����Cu2S������Ҫ�����ã��ù��̿��ܾ������귴Ӧ��ɣ����䲹��������
��_____________________________�������ӷ���ʽ��ʾ��
��MnO2+2Fe2++4H+= Mn2++2Fe3++2H2O
��3���������һ�ּ�ʽ�Σ�Ϊ�ⶨ�Ļ�ѧʽ����������ʵ�飺
����1��ȡ19.2 g����ף���������ϡ�����ܽ⣬��������Һ��ΪA��B���ȷݣ�
����2����A�м���������NaOH��Һ�����ȣ����ռ���0.448L NH3����״���£����˺���������ϴ�Ӹ��ﲢ�������������ٱ仯���ɵ�4.80g����ɫ���������
����3����B�м���������BaCl2��Һ�����ˡ�ϴ�ӡ�����ɵ�9.32g���������
�����Ļ�ѧʽΪ_________________
��4��������ʵ��ܽ������ͼ���ӳ��������Һ��ͨ��һϵ�еIJ����ֱ�������ͭ�������̾��壬����������IJ���˳�����в�����ѡȡ�����Ⱥ�����г���ĸ���������ظ�ʹ�ã�����Һ��( ) ��( )��( ) ��(A) ��( ) ��( ) ���� ����_____________
A.�����ܼ� B�����ȹ��� C����ȴ�ᾧ D.����
E������Һ��������Һ������־�Ĥ F������Һ�����������ײ����ִ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl2���ж��е���ɫ������������ӡȾ����ֽ��ҵ����ˮ������FeCl3�ڼ�����������ˮ����ˮ�⡣FeCl3��FeCl2��������C6H5Cl��C6H4Cl2�������ش��������⣺
(1)��FeCl3��6H2O�Ƶø���FeCl2�Ĺ������£�
i����ʢ��FeCl3��6H2O�������м������SOCl2(Һ�壬��ˮ��)�����ȣ������ˮFeCl3��
ii������ˮFeCl3���ڷ�Ӧ���У�ͨ��һ��ʱ����������ټ��ȣ�����FeCl2��
��FeCl3��6H2O�м���SOCl2�����ˮFeCl3�Ļ�ѧ����ʽΪ__________________��(��֪�÷�ӦΪ��������ԭ��Ӧ)
��ʹ��NH4SCN���Լ��� ii��FeCl3�Ƿ���ȫת������д�����ӷ�Ӧ����ʽ_____________��
(2)���÷�Ӧ2FeCl3 + C6H5Cl ![]() 2FeCl2+ C6H4Cl2 +HCl������ȡ��ˮFeCl2����������ƿ�м�����ˮ�Ȼ����������ȱ������Ʒ�Ӧ�¶���һ����Χ�ڼ���3 h����ȴ�����롢�ᴿ�õ��ֲ�Ʒ��ʵ��װ����ͼ��(����װ����ȥ)
2FeCl2+ C6H4Cl2 +HCl������ȡ��ˮFeCl2����������ƿ�м�����ˮ�Ȼ����������ȱ������Ʒ�Ӧ�¶���һ����Χ�ڼ���3 h����ȴ�����롢�ᴿ�õ��ֲ�Ʒ��ʵ��װ����ͼ��(����װ����ȥ)

������B��������_________ ��C���Լ�������________��
����Ӧ��������ȴʵ��װ��A����������ƿ�����ʵ�������______��_______������õ�FeCl2�ֲ�Ʒ��
����װ�ô��ڵIJ���֮����__________________________��
(3)�ֲ�Ʒ��FeCl2�Ĵ��Ȳⶨ��
��ȡa g�ֲ�Ʒ���Ƴ�100 mL��Һ��������Һ����ȡ������Һ5.00mL������500 mL��ƿ�ڲ���ˮ�����Ϊ200mL������0.100 mol��L-1����KMnO4����Һ�ζ����յ�ʱ��������KMnO4����ҺV mL������֪�������Ը��������ҺΪVmL��������Һ���ܶ���(FeCl2)=kV ���ܶȵĵ�λΪg��L-1����k=___________g��L-1��mL-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���1molA(g)��1molB(g)����2L�ܱ������з�����Ӧ��A(g)+B(g) ![]() xC(g)+D(s)��H<0���� t1 ʱ��ƽ�⡣�� t2 ��t3 ʱ�̷ֱ�ı䷴Ӧ��һ����������������� C(g)��Ũ����ʱ��仯��ͼ��ʾ�������й�˵����ȷ����
xC(g)+D(s)��H<0���� t1 ʱ��ƽ�⡣�� t2 ��t3 ʱ�̷ֱ�ı䷴Ӧ��һ����������������� C(g)��Ũ����ʱ��仯��ͼ��ʾ�������й�˵����ȷ����

A. t2 ʱ�̸ı��������ʹ�ô���
B. t3ʱ��v(��)����С��t2 ʱ��v(��)
C. t3ʱ�̸ı������һ��������Ӧ���Ũ��
D. t1��t2��t2��t3ƽ�ⳣ����Ϊ0.25
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ��ǿ������������������������ȡ�
(1)O3��KI��Һ��Ӧ���ɵ����ֵ�����______________��________________(�����ʽ)��
(2)O3��ˮ���ֽ⣬һ�������£�O3��Ũ�ȼ���һ�������ʱ��(t)���±���ʾ����֪��O3����ʼŨ��Ϊ0.0216 mol/L��
T/�� | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
��pH�����ܼ���O3�ֽ⣬������O3�ֽ�������õ���________��
����30 �桢pH��4.0�����£�O3�ķֽ�����Ϊ________mol/(L��min)��
�۾ݱ��еĵݱ���ɣ��Ʋ�O3�����������·ֽ��������������˳��Ϊ________(����ĸ����)��
a��40 �桢pH��3.0
b��10 �桢pH��4.0
c��30 �桢pH��7.0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��д��ȷ���ǣ�
A.2SO2+O2![]() 2SO3 ��H=-196.6 kJ��mol-1
2SO3 ��H=-196.6 kJ��mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ��H=-285.5 kJ��mol-1
O2(g)=H2O(l) ��H=-285.5 kJ��mol-1
C.2H2(g)+O2(g)=2H2O(l) ��H=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ��H=+393.5 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵������ȷ����( )
A. ˮ��ͭ���ӵ�ģ����ͼ��ʾ��1��ˮ��ͭ��������4����λ��
ˮ��ͭ���ӵ�ģ����ͼ��ʾ��1��ˮ��ͭ��������4����λ��
B. CaF2����ľ�����ͼ��ʾ��ÿ��CaF2����ƽ��ռ��4��Ca2+
CaF2����ľ�����ͼ��ʾ��ÿ��CaF2����ƽ��ռ��4��Ca2+
C. Hԭ�ӵĵ�����ͼ��ͼ��ʾ��Hԭ�Ӻ���Ĵ����������ԭ�Ӻ˸����˶�
Hԭ�ӵĵ�����ͼ��ͼ��ʾ��Hԭ�Ӻ���Ĵ����������ԭ�Ӻ˸����˶�
D. ����Ag��ԭ�Ӷѻ�ģ����ͼ��ʾ���ý�������Ϊ���ܶѻ���ÿ��Agԭ�ӵ���λ����Ϊ12
����Ag��ԭ�Ӷѻ�ģ����ͼ��ʾ���ý�������Ϊ���ܶѻ���ÿ��Agԭ�ӵ���λ����Ϊ12
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com