
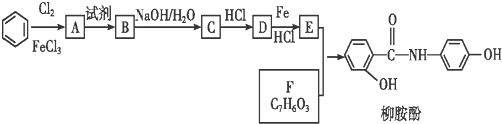
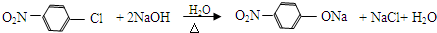
 .
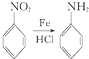
.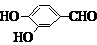 、
、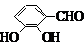 、
、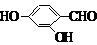 、
、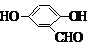 (其中三种)(写出3种).
(其中三种)(写出3种).分析 苯和氯气发生取代反应生成A,A为 ,F中不饱和度=$\frac{7×2+2-6}{2}$=5,根据柳胺酚结构简式知,F中含有苯环和碳氧双键,所以F为
,F中不饱和度=$\frac{7×2+2-6}{2}$=5,根据柳胺酚结构简式知,F中含有苯环和碳氧双键,所以F为 ;
;
E为 ,D和铁、HCl反应生成E,结合题给信息知,D结构简式为
,D和铁、HCl反应生成E,结合题给信息知,D结构简式为 ;
;
A反应生成B,B和NaOH水溶液发生取代反应生成C,根据D结构简式知,A和浓硝酸发生取代反应生成B,B为 ,C为
,C为 ,C和HCl反应生成D,据此分析解答.
,C和HCl反应生成D,据此分析解答.
解答 解:苯和氯气发生取代反应生成A,A为 ,F中不饱和度=$\frac{7×2+2-6}{2}$=5,根据柳胺酚结构简式知,F中含有苯环和碳氧双键,所以F为
,F中不饱和度=$\frac{7×2+2-6}{2}$=5,根据柳胺酚结构简式知,F中含有苯环和碳氧双键,所以F为 ;
;
E为 ,D和铁、HCl反应生成E,结合题给信息知,D结构简式为
,D和铁、HCl反应生成E,结合题给信息知,D结构简式为 ;
;
A反应生成B,B和NaOH水溶液发生取代反应生成C,根据D结构简式知,A和浓硝酸发生取代反应生成B,B为 ,C为
,C为 ,C和HCl反应生成D,
,C和HCl反应生成D,
(1)A.柳胺酚中酚羟基、肽键水解生成的羧基能和NaOH反应,所以1mol柳胺酚最多可以和3mol NaOH反应,故错误;
B.柳胺酚中含有苯环,可以发生硝化反应,故错误;
C.含有肽键,所以可发生水解反应,故正确;
D.含有酚羟基,溴和苯环上酚羟基邻对位氢原子发生取代反应,故正确;
故选CD;
(2)A→B引入硝基,必有硝酸参与反应,还需浓硫酸做催化剂,故反应所需的试剂为:浓硝酸和浓硫酸,故答案为:浓硝酸和浓硫酸;
(3)B→C的化学方程式为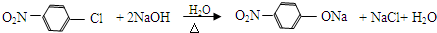 ,
,
故答案为: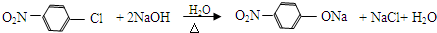 ;
;
(4)由上述分析可知,化合物F的结构简式为: ,故答案为:
,故答案为: ;
;
(5)F( )的同分异构体同时符合下列条件:属酚类化合物,且苯环上有三种不同化学环境的氢原子;能发生银镜反应,含有醛基或甲酸形成的酯基,符合条件的3种同分异构体为:
)的同分异构体同时符合下列条件:属酚类化合物,且苯环上有三种不同化学环境的氢原子;能发生银镜反应,含有醛基或甲酸形成的酯基,符合条件的3种同分异构体为: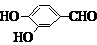
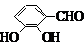
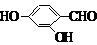
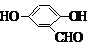
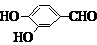
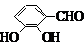
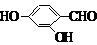
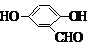
(6)在催化剂作用下,苯和乙烯发生加成反应生成苯乙烷,在光照条件下,苯乙烷发生取代反应生成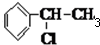 ,在加热条件下,
,在加热条件下,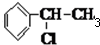 和氢氧化钠的醇溶液发生消去反应生成苯乙烯,在催化剂条件下,苯乙烯发生加聚反应生成聚苯乙烯,所以其合成路线为:
和氢氧化钠的醇溶液发生消去反应生成苯乙烯,在催化剂条件下,苯乙烯发生加聚反应生成聚苯乙烯,所以其合成路线为: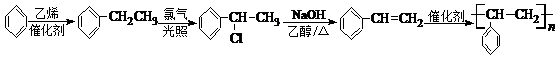
故答案为: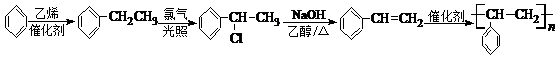
点评 本题考查有机合成,考查学生分析推断能力,会根据反应条件、有机物结构并采用正逆结合的方法进行推断,难点是有机合成路线的设计,可以根据反应物采用正向推导方法或根据目标产物采用逆向推导的方法设计合成类型,要求学生对有机反应类型、有机反应条件掌握熟练并灵活运用,题目难度中等.


科目:高中化学 来源: 题型:解答题
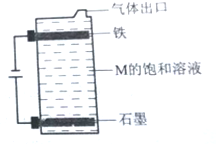 A、B、C、D、E为原子序数依次增大的短周期元素.A、C处于同一主族,C、D、E处于同一周期;A、B组成的气体X能使湿润的红色石蕊试纸变蓝.C在短周期元素中金属性最强,E原子的最外层电子数是A、B、C原子最外层电子数之和,E的单质与x反应能生成溶于水呈强酸性的化合物Z,同时生成B的单质,D的单质既能与C的最高价氧化物的水溶液反应,也能与Z的水溶液反应;C、E可组成化合物M.
A、B、C、D、E为原子序数依次增大的短周期元素.A、C处于同一主族,C、D、E处于同一周期;A、B组成的气体X能使湿润的红色石蕊试纸变蓝.C在短周期元素中金属性最强,E原子的最外层电子数是A、B、C原子最外层电子数之和,E的单质与x反应能生成溶于水呈强酸性的化合物Z,同时生成B的单质,D的单质既能与C的最高价氧化物的水溶液反应,也能与Z的水溶液反应;C、E可组成化合物M.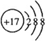 .
.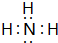 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
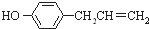 )是植物挥发油中的一种成分,1mol胡椒酚最多可与a mol H2发生反应、最多可与b mol Br2在水溶液中发生反应,则a、b分别是( )
)是植物挥发油中的一种成分,1mol胡椒酚最多可与a mol H2发生反应、最多可与b mol Br2在水溶液中发生反应,则a、b分别是( )| A. | 4 3 | B. | 4 2 | C. | 3 3 | D. | 3 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
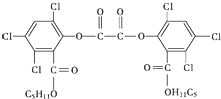 “魔棒”常被用于晚会现场气氛的渲染.“魔棒”发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法中正确的是( )
“魔棒”常被用于晚会现场气氛的渲染.“魔棒”发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法中正确的是( )| A. | CPPO难溶于水 | |
| B. | CPPO属于芳香烃也属于高分子化合物 | |
| C. | 1 mol CPPO与氢气完全反应,需要10 mol H2 | |
| D. | 1 mol CPPO与NaOH稀溶液反应(不考虑苯环上氯原子水解),最多消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
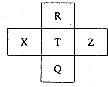 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,R元素原子最外层电子数等于其电子层数的3倍,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,R元素原子最外层电子数等于其电子层数的3倍,下列判断正确的是( )| A. | X元素的最高价氧化物对应的水化物酸性强于T元素 | |
| B. | 原子半径:R<T<Z | |
| C. | Z的单质可从T的气态氢化物中置换出T的单质 | |
| D. | R、T、Q最高正价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2和CO浓度比 | B. | 混合气体的密度 | C. | 转化率 | D. | CO 的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 1.0 | 2.0 | 6.4 |

| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 键的极性:H2O>H2S | B. | 导电性:HF溶液<HCl溶液 | ||
| C. | 燃烧热:△H(C)(s,石墨)>△H(CO)(g) | D. | 耐腐蚀性:铝<生铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com