
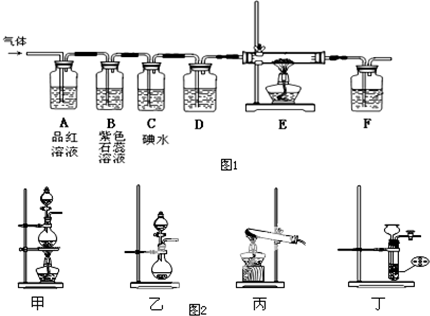
分析 (1)图2装置常用于实验室制取气体,利用浓盐酸与二氧化锰加热制取氯气,为固液反应加热装置;利用浓硫酸与亚硫酸钠反应制取二氧化硫,为固液反应不加热装置;
(2)通氯气时,紫色石蕊先变红后褪色,而通二氧化硫,紫色石蕊变红;装置A反应后溶液均褪色,若为氯气,褪色后不恢复,而二氧化硫漂白是暂时性的;
(3)F中试剂可吸收尾气,E中试剂为铁丝,则通入氯气与铁丝反应生成氯化铁;
(4)二氧化硫与碘水发生氧化还原反应生成硫酸和HI,滴加淀粉无现象.
解答 解:(1)图2装置常用于实验室制取气体,利用浓盐酸与二氧化锰加热制取氯气,为固液反应加热装置,则选择装置为甲,离子反应为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;利用浓硫酸与亚硫酸钠反应制取二氧化硫,为固液反应不加热装置,则选择装置为乙,
故答案为:甲;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;乙;
(2)通氯气时,紫色石蕊先变红后褪色,而通二氧化硫,紫色石蕊变红,则B中现象不同;二氧化硫具有漂白性,氯气与水反应生成HClO,HClO具有漂白性,故通入二氧化硫与通入氯气,装置A中的品红溶液都褪色,利用褪色后的溶液判断是何种气体的方法为取适量A中溶液,加热后又变为红色,说明为二氧化硫,若加热不恢复红色,说明为氯气,
故答案为:不相同;取适量A中溶液,加热后又变为红色,说明为二氧化硫,若加热不恢复红色,说明为氯气,
(3)由装置可知,E的作用是吸收尾气,防止污染空气,可以用NaOH溶液吸收,氯气与铁反应生成氯化铁,观察到产生棕红色的烟,故答案为:NaOH;产生棕红色的烟;
(4)二氧化硫与碘水发生氧化还原反应生成硫酸和HI,滴加淀粉无现象,发生的离子反应为2H2O+SO2+I2=SO42-+2I-+4H+,故答案为:2H2O+SO2+I2=SO42-+2I-+4H+.
点评 本题考查性质实验方案的设计,为高频考点,把握二氧化硫、氯气的制备实验及性质实验为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NO2不断通人FeS04溶液中 | B. | CO2不断通人CaCIz溶液中 | ||
| C. | NH3不断通入AICl3溶液中 | D. | SO2通人已酸化的Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、H+、NO3-、HCO3- | B. | K+、Mg2+、SO42-、NH3•H2O | ||
| C. | Na+、K+、SO32-、Cl2 | D. | Na+、Ba2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥ | B. | ②⑤ | C. | ①②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com