
| A. | 原子半径:Na>Mg>O | |
| B. | 13C和14C属于同位素 | |
| C. | 0族元素是同周期中非金属性最强的元素 | |
| D. | N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强 |
分析 A.一般来说原子核外电子层数越多,原子半径越大,同周期元素自左向右原子半径逐渐减小,故A正确;
B.质子数相同、中子数不同的原子互为同位素;
C.同周期非金属性最强的元素位于第ⅦA;
D.非金属性越强,相应最高价氧化物对应水化物的酸性就越强.
解答 解:A.同周期元素自左向右原子半径逐渐减小,则Na>Mg,一般来说原子核外电子层数越多,原子半径越大,O原子半径最小,故A正确;
B.13C和14C的质子数相同,质量数不同,所以这两种核素互称为同位素,故B正确;
C.同周期元素从左到右元素的非金属性逐渐增强,同周期非金属性最强的元素位于第ⅦA,0族元素活泼性较弱,故C错误;
D.同主族元素自上而下非金属性是减弱的,非金属性越强,相应最高价氧化物对应水化物的酸性就越强,故D正确.
故选C.
点评 本题考查元素周期率知识,为高考常见题型和高频考点,侧重于元素对应单质、化合物的性质的递变规律的考查,注意把握性质的递变规律,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 由X,Y,Z组成的盐的水溶液中阳离子总浓度大于阴离子总浓度 | |
| B. | YX3的水溶液呈弱碱性,能使湿润的蓝色石蕊试纸变红 | |
| C. | X与Z形成的化合物的水溶液可用于雕刻玻璃 | |
| D. | W的氯化物熔点低,易升华,但其水溶液能导电,由此推断它属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;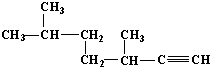 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔;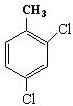 ;
; ,分子式为C15H22O2;
,分子式为C15H22O2;  中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | ||||
| R |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )
则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. ,反应类型取代反应.
,反应类型取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com