

 .
. 反应类型:加聚反应.
反应类型:加聚反应. 分析 乙烯与水发生加成反应生成B,则B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应CH3CHO,C为CH3CHO,B与D反应生成乙酸乙酯(CH3COOCH2CH3),则D为CH3COOH,乙烯发生加聚反应生成聚乙烯( ),以此来解答.
),以此来解答.
解答 解:(1)乙烯的电子式为 ,乙烯的结构式为
,乙烯的结构式为 ,故答案为:
,故答案为: ;
;
(2)B为CH3CH2OH,含有的官能团为羟基,故答案为:-OH;羟基;
(3)乙醇发生催化氧化可生成乙醛,方程式为2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,乙烯发生加聚反应可生成聚乙烯,方程式为n CH2=CH2$\stackrel{催化剂}{→}$ ,
,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O;氧化反应;n CH2=CH2$\stackrel{催化剂}{→}$ ;加聚反应.
;加聚反应.
点评 本题考查有机物的推断,为高频考点,把握有机物的性质、转化反应中官能团的变化、有机反应等为解答的关键,侧重分析与推断能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 配制稀盐酸用量筒量取浓盐酸时,俯视刻度线 | |
| B. | 用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒2-3次,洗液倒入烧杯中 | |
| C. | 称量11.7 g NaCl配制0.2 mol/L NaCl溶液时,砝码错放在左盘 | |
| D. | 定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知:①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O某小组进行如下实验:
已知:①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O某小组进行如下实验:| 假设 | 操作 | 现象 | 原理 |
| Na2S2O4 为强 碱弱酸盐,其溶 液为碱性. | 取少量溶液于试管中, 滴加紫色水蕊试液 | 溶液变 成蓝色 | S2O42-水解,使溶液成碱性 |
| Na2S2O4 中 S为+3 价,具有较强 的还原性. | 取少量溶液于试管中, 滴加过量新制氯水,再 滴加 BaCl2 溶 | 有白色沉淀生 成 | 该反应的离子方程式为:4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ ,Ba2++SO42-=BaSO4↓; |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24LH2O含有的分子数等于0.1NA | |
| B. | 1.12LO2和1.12LN2所含原子数一定相等 | |
| C. | 分子数为NA的CO气体质量为28克 | |
| D. | 500mL2mol/L的氯化钙溶液中Cl数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 上述电池分别属于一次电池、二次电池和燃料电池 | |
| B. | 干电池在长时间使用后,锌筒被破坏 | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 铅蓄电池工作过程中,每通过 2 mol 电子,负极质量减轻 207 g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
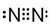 、
、 、
、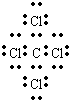 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大多数合金的熔点比它的各成分金属的高 | |
| B. | 生铁和钢都是铁的合金,生铁的含碳量低于钢 | |
| C. | 日常生活中使用更多的是纯金属而不是合金 | |
| D. | 青铜是我国使用最早的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com