
【题目】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)写出E元素名称:________
(2)C基态原子的电子排布图为___________________,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(3)当n=2时,BC分子的结构式是 ________;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是______________。
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________(用元素符号表示)。
(5)E元素原子的价电子排布式是________,在元素周期表中位置是______________,其最高价氧化物的化学式是______________。
【答案】 锰 ![]() σ C≡O SiO2 + 2OH-=SiO32- +H2O O>P>Si>Li 3d54s2 第四周期第ⅦB族 Mn2O7
σ C≡O SiO2 + 2OH-=SiO32- +H2O O>P>Si>Li 3d54s2 第四周期第ⅦB族 Mn2O7
【解析】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布为ms1,A位于ⅠA族;B元素的原子价电子排布式为ns2np2,B位于ⅣA族;C元素位于第二周期且原子中p能级与s能级电子总数相等,则原子的电子排布式为1s22s22p4,故C为氧元素;D元素原子的M能层的P能级中有3个未成对电子,则D元素原子电子排布式为1s22s22p63s23p3,D为P元素;E元素原子有5个未成对电子,则E的电子排布式为:1s22s22p63s23p63d54s2,E为Mn元素。
(1). E是锰元素,故答案为:锰;
(2). 氧是8号元素,基态原子的电子排布图为![]() ,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为氢原子的1s电子与氧原子的2p电子采取“头碰头”的方式成键,属于σ键,故答案为:
,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为氢原子的1s电子与氧原子的2p电子采取“头碰头”的方式成键,属于σ键,故答案为:![]() ;σ;
;σ;
(3). 当n=2时,B为C元素,CO分子的结构式为:C≡O;当n=3时,B为Si元素,与氧元素形成的化合物是二氧化硅,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,离子方程式为:SiO2 + 2OH-=SiO32- +H2O,故答案为:C≡O ;SiO2 + 2OH-=SiO32- +H2O;
(4). 若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布式为3s23p2,B为Si元素,同周期元素自左至右第一电离能呈增大趋势,同主族元素自上而下第一电离能逐渐减小,非金属性越强第一电离能越大,故第一电离能由大到小的顺序为:O>P>Si>Li,故答案为:O>P>Si>Li;
(5). E是锰元素,价电子排布式为:3d54s2,在元素周期表中处于第四周期第ⅦB族,锰元素的最高正化合价为+7价,则其最高价氧化物的化学式是Mn2O7,故答案为:3d54s2;第四周期第ⅦB族;Mn2O7。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】历史表明:没有新材料的出现,就没有科技和生产发展的突破。信息高速公路的建立在于寻找新的信息材料。下列材料可作信息材料的是( )
A. 铜线B. 化纤C. 橡胶D. 光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是教师在课堂中演示的两个实验装置(铁架台等辅助仪器略去)

请回答下列问题
(1)实验一的实验目的是 _____________________________________ , 实验过程中可以观察到烧杯中的现象是_______________________________________________________ ,加热后试管中发生反应的化学方程式是: ____________________________
(2)实验二用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花燃烧。Na2O2与CO2的反应的化学方程式________________________________________ ,该实验可以得出许多结论,请你写出由该实验得出的两个结论。
结论1:__________________________________
结论2:__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液pH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是

A. a、b、c、d四个点中,水的电离程度最大的是d
B. 常温下,NH3·H2O的电离平衡常数Kb=5×10-6
C. b点溶液中:c(Na+)+c(NH4+)=c(SO42—)
D. c点溶液中:3c(Na+)= 4[c(SO42—) +c(NH4+)+ c(NH3·H2O)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
苯酚是一种重要的化工原料,以苯酚为主要起始原料,经下列反应可制得香料M 和高分子化合物N(部分产物及反应条件已略去):
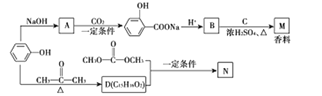
已知化合物N为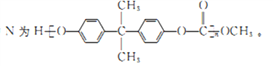
回答下列问题:
(1)B的结构简式为________________,B中能与NaHCO3反应的官能团名称是_______________。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的核磁共抓氢谱有3组峰,峰面积比值是9: 2:1,则M的结构简式为_________________。
(3)由苯酚生成D的化学方程式为______________________。
(4)化合物D与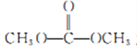 发生反应,除生成化合物N 外,还生成_____________(写结构简式)。 (5)F是相对分子质量比B大14的同系物,F有多种同分异构体,符合下列条件的F的同分异构体有_____种。①属于芳香族化合物 ②遇FeCl3 溶液显紫色,且能发生水解反应
发生反应,除生成化合物N 外,还生成_____________(写结构简式)。 (5)F是相对分子质量比B大14的同系物,F有多种同分异构体,符合下列条件的F的同分异构体有_____种。①属于芳香族化合物 ②遇FeCl3 溶液显紫色,且能发生水解反应
③苯环上有两个取代基
(6)已知: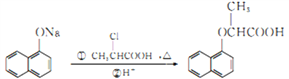 ,写出用苯酚、乙醇和ClCH2COOH为原料制备化合物
,写出用苯酚、乙醇和ClCH2COOH为原料制备化合物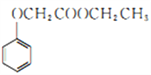 的合成路线_________________(其他试剂任选)。
的合成路线_________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂:①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42-。提纯时的操作步骤和加入试剂的情况如图。

图中a、b、c、d分别表示上述4种试剂中的一种,请回答:
(1)沉淀A的名称是________。
(2)试剂d是________;判断试剂d已经足量的方法是__________________________。
(3)加入b、c后溶液中发生的化学反应的化学方程式有______________________(任写两个)。
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到的是____(填序号),仪器③的名称是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属的冶炼方法正确的是( )
A.电解氯化钠溶液冶炼金属钠
B.电解熔融的氯化铝冶炼金属铝
C.将铁粉与氧化镁混合加热冶炼镁
D.用一氧化碳还原氧化铁冶炼铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期律的叙述中,正确的是
A.氧化性强弱:F2<Cl2B.金属性强弱:Na<Mg
C.酸性强弱:H3PO4<H2SO4D.原子半径大小:N<O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com