
下列化合物中阴离子半径和阳离子半径之比最大的是 ( )
A.LiI B.NaBr C.KCl D.CsF
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届天津市五区县高一上学期期末考试化学试卷(解析版) 题型:选择题
人类的生产生活离不开化学,下列关于生活中的化学知识说法错误的是 ( )
A.用氯气与石灰乳反应能制得漂白粉
B.常温下,可用铝槽车装运浓硝酸
C.二氧化碳、二氧化硫是形成酸雨的主要原因
D.不需要通过化学反应就能从海水中获得食盐和淡水
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高一上学期期末质量检测化学试卷(解析版) 题型:选择题
用下图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
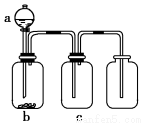
气体abc
ANO2浓硝酸铜片浓硫酸
BSO2浓硫酸Cu酸性KMnO4溶液
CCO2稀硫酸CaCO3浓硫酸
DNH3浓氨水生石灰浓硫酸
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:填空题
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B ,C ,指出D在周期表中的位置 。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为 (用化学式表示)。
(3)写出淡黄色固体E的电子式 ,其中含有的化学键为 。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式 。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它
们的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
某电荷数小于18的元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。下列有关元素X的说法中,不正确的是 ( )
A.元素X的原子核内质子数为(2a2-1)
B.元素X形成的单质既能作氧化剂又能作还原剂
C.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)
D.由元素X形成的某些化合物,可能具有杀菌消毒的作用
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列混合物的分离方法不正确的是( )
A.水和汽油的混合物用分液方法分离
B.石灰水中悬浮的固体碳酸钙用过滤方法分离
C.碘水中的碘用酒精萃取分离
D.乙醇中溶解微量食盐,用蒸馏方法分离
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:填空题
工业上常常利用反应①来生产环氧乙烷,但是伴随副反应②。
①C2H4(g)+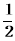 O2(g) →
O2(g) →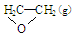 ; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
(1)写出环氧乙烷充分燃烧的热化学反应方程式。答:____________________________;
(2)工业生产中,可通过某一措施来加快反应①而对反应②影响较小,从而提高环氧乙烷的生产效率。工业生产采取的这种措施是_______________。
A.升高反应体系的温度B.增大体系中氧气的浓度
C.使用合适的催化剂D.降低反应体系的压强
(3)已知C=C、O=O、C—C键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,则环氧乙烷中C—O键能为 kJ·mol-1;
(4)反应②可以设计成燃料电池,若以酸做电解质溶液,负极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:填空题
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
元素ABCD
性质结构信息原子中最外层电子数为电子层数的2倍。常温下为淡黄色固体,其燃烧热为Q KJ/mol单质常温、常压下是气体,能溶于水。原子的M层p轨道有1个未成对的电子 单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 原子最外层电子层上s电子数等于p电子数。单质是一种重要的半导体材料。
(1)写出A的燃烧热方程式 。
(2)写出B单质与水反应的化学方程式 。
(3)电解B与C的化合物水溶液是重要化学工艺,写出离子方程式 。
(4)A与C形成的化合物存在的化学键为 (填“共价键”或“离子键”)。
(5)A、B、D三种元素电负性由小到大的顺序为 (写元素符号)。
(6)B、D两元素非金属性较弱的是 (写元素符号)。请设计一个实验证明这一结论: 。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:填空题
铁和铁的化合物用途广泛。请回答下列问题:
(1)写出在潮湿空气中钢铁锈蚀时正极反应的电极反应式:_______________________。
将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:______________________________________。
(2)爱迪生蓄电池的反应式为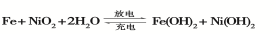
①爱迪生蓄电池的正极是 , 该电池工作一段时间后必须充电,充电时生成Fe的反应类型是______。
②高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。写出在用电解法制取高铁酸钠时,阳极的电极反应式___________________________________。
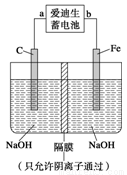
③你认为高铁酸钠作为一种新型净水剂的理由错误的是 ______。
a.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
b.高铁酸钠在消毒杀菌时被还原生成Fe3+,Fe3+水解产生氢氧化铁胶体能吸附悬浮杂质
c.高铁酸钠具有强氧化性,能消毒杀菌
d.高铁酸钠具有强还原性,能消毒杀菌
(3)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4︰5,其中Fe2+与Fe3+物质的量之比为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com