
【题目】(1)从下列四组物质中选择合适的一组,将对应字母填写在空格内。
A.H2O和Na2O B.空气和碘酒
C.CuSO4·5H2O D.C2H4和C2H5OH
其中属于混合物的是__________;属于盐的是__________;属于有机物的是__________;属于氧化物的是__________。
(2)在高温时,水蒸气与灼热的炭发生氧化还原反应的化学方程式是C+H2O![]() H2+CO,其中氧化剂是__________;还原剂是__________。
H2+CO,其中氧化剂是__________;还原剂是__________。
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】某冶金厂的矿渣含有较多的Al2O3、Fe2O3、MgO、SiO2,现欲进行综合利用以提取氧化铝、氧化镁、氧化铁作为工业原料,其设计的工艺流程如下:
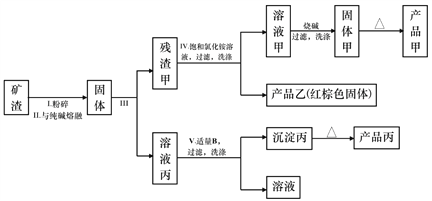
已知:
①硅酸的酸性比氢氧化铝强。
②饱和氯化铵溶液的pH约为5。
③氢氧化镁开始沉淀至沉淀完全的pH范围:9.0~12.0。
④氢氧化铁开始沉淀至沉淀完全的pH 范围:2.7~4.0。
回答下列问题:
(1)写出过程II中发生反应的化学方程式:_______________、_____________________。
(2)过程Ⅲ的名称是_______________;产品乙的俗名是_________________。
(3)过程V中所用适量的B是一种常见气体,过程V中所发生的反应的离子方程式为_______。
(4)残渣甲用饱和氯化铵溶液能部分溶解的原因是_______________(用离子方程式表示)。
(5)解释工业上不用电解产品甲制备相应金属单质的原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(CH2O)、乙酸(C2H4O2)和丙醛(C3H6O)组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为
A. 27% B. 28% C. 54% D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠(Na2SO3)在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上可能被还原成的是
①H2SO4 ②S ③Na2S ④Na2SO4 ⑤H2SO3 ⑥Na2S2O3
A. ①④ B. ①②③ C. ①⑤⑥ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物、和水产资源等(如图所示),下列有关说法正确的是

A. 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B. 工业上金属钠是通过氯碱工业制取
C. 从第③步到第⑤步的目的是为了浓缩
D. 在第③④⑤步中溴元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如下图,则下列说法正确的是( )

A. 阳极产物一定是Cl2,阴极产物一定是Cu
B. BC段表示在阴极上是H+放电产生了H2
C. 整个过程中阳极先产生Cl2,后产生O2
D. CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1moL/L醋酸用蒸馏水稀释的过程中,下列说法正确的是( )
A.电离程度增大,H+浓度增大B.电离程度减小,H+浓度减小
C.电离程度增大,H+浓度减小D.电离程度减小,H+浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)已知:(i)氢气的燃烧热为286.0 kJ mol-1
(ii)4NH3(g)+3O2(g)![]() 2N2(g)+6H2O △H=-1530.6kJmol-1。
2N2(g)+6H2O △H=-1530.6kJmol-1。
①合成氨反应的热化学方程式为__________________________________。
②对于反应(ii),正、逆反应活化能的大小关系为:E正_______E逆 (填>、=或<)。
(2)恒温恒容条件下,起始按物质的量之比为1 : 1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_________;然后只降低温度,N2(g)的体积分数会______(填选项字母)。
A.增大 B.减小 C.不变 D.不能判断
(3)T℃ 时,CO2(g)和 NH3(g)合成尿素的原理为 2NH3(g)+ CO2(g)![]() CO(NH2)2(s)+H2O(l)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2mol L-1
CO(NH2)2(s)+H2O(l)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2mol L-1
①0-2 min内,用NH3表示的反应速率v(NH3)=___________;反应的平衡常数K=__________。
②若其他条件不变,2 min时将容器体积迅速压缩到1 L,在3 min时重新达到平衡,请在图1中画出23 min内c(NH3)随时间(t)变化的曲线关系图:__________。

(4)电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图2所示:
①电源正极为___________(填“A”或“B”),阴极反应式为________________________________。
②若电解过程中转移了 1 mol e-,则膜两侧电解液的质量变化差值(Δm正-Δm右)为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com