
| A. | 钠和钾的合金可用于快中子反应堆作热交换剂 | |
| B. | 可用超纯硅制造的单晶硅来制造计算机的芯片 | |
| C. | 实验室用二氧化锰和浓盐酸共热制取少量氯气 | |
| D. | 氢氧化钠溶液要盛放在磨口玻璃塞的试剂瓶里 |
分析 A.钠钾合金熔点低,具有良好的导热性;
B.硅的导电性介于导体与绝缘体之间;
C.二氧化锰在加热条件下能够氧化浓盐酸生成氯气;
D.玻璃中含有二氧化硅和氢氧化钠反应生成矿物胶硅酸钠会粘结瓶口和瓶塞.
解答 解:A.钠钾合金为液态,可作快中子反应堆作热交换剂,故A正确;
B.硅的导电性介于导体与绝缘体之间,是良好的半导体材料,可以制造计算机的芯,故B正确;
C.二氧化锰在加热条件下能够氧化浓盐酸生成氯气,故C正确;
D.玻璃中含有二氧化硅和氢氧化钠反应生成矿物胶硅酸钠会粘结瓶口和瓶塞,盛放氢氧化钠溶液的玻璃试剂瓶不能用玻璃塞,故D错误;
故选:D.
点评 本题考查了物质的用途、保存,熟悉相关物质的性质是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | (NH4)2CO3+H2SO4═(NH4)2SO4+H2O+CO2↑ | |
| B. | NaHCO3+HNO3═NaNO3+H2O+CO2↑ | |
| C. | Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑ | |
| D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
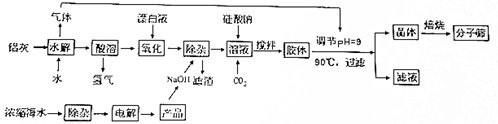
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NO2):V(O2)=2:1 | B. | V(NO):V(O2)=2:1 | ||
| C. | V(NH3):V(O2)=2:1 | D. | V(NO2):V(NO):V(O2)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
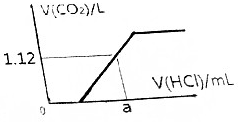 取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.
取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 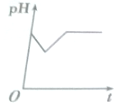 | B. | 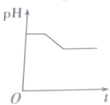 | C. | 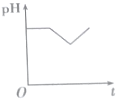 | D. | 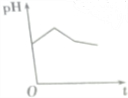 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,c(NH4+)大小顺序为:③>②>① | |
| C. | 等体积,等物质的量浓度的Na2S溶液与NaHS溶液混合后:3c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 等体积、等物质的量浓度的Na2SO3溶液与HCl溶液混合后:c(H+)+c(H2SO3)═c(SO32-)++c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com