
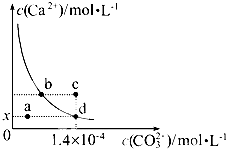
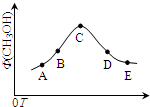
 室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9,下列说法不正确的是( )| A、加入蒸馏水可使溶液由d点变到a点 |
| B、c点时有碳酸钙沉淀生成 |
| C、x数值为2×10-5 |
| D、b点与d点对应的溶度积相等 |


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>④>③>⑤ |
| B、③>①>④>②>⑤ |
| C、⑤>③>②>①>④ |
| D、③>④>⑤>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
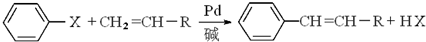 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.1mol/LNaOH溶液 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol/L氨水 | 0.1mol/LMgCl2溶液 | 无现象 |
| Ⅲ | 1mol/L氨水 | 1mol/LMgCl2溶液 | 现象Ⅲ |
| Ⅳ | 1mol/L氨水 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol/L氨水 | 1mol/LMgCl2溶液 | 无现象 |
| A、实验Ⅱ、Ⅴ无现象,而Ⅳ生成白色沉淀,说明增大c(Mg2+)不能向生成沉淀的方向移动,增大氨水溶液的浓度才能向生成沉淀的方向移动 |
| B、实验Ⅲ无现象,因为氯化镁溶液和氨水浓度都增大,则导致氯化铵浓度增大,而氢氧化镁可以溶解在氯化铵溶液中 |
| C、由于氢氧化镁可以溶解在氯化铵溶液中,而氯化镁溶液和氨水反应可以生成氯化铵,所以该两种溶液混合后可能会出现先生成沉淀后溶解的现象 |
| D、实验Ⅲ的现象是生成白色沉淀,因为增大两种溶液中任意一种的浓度,都能使混合液的离子积达到氢氧化镁的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 陈述Ⅲ |
| A | 加压有利于提高SO2的转化率 | 工业生产硫酸常在高温下进行 | Ⅰ对,Ⅱ对;有 |
| B | Cl2和SO2混合后可用来漂白纸浆 | Cl2和SO2都有较好的漂白作用 | Ⅰ对,Ⅱ错;无 |
| C | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | Ⅰ对,Ⅱ对;有 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对,Ⅱ对;有 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
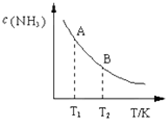 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:| 一定条件 |
| 时间/min 浓度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 火力发电厂释放出的大量氧化物(NOx)、SO2、CO2会对环境造成污染.对这些废气进行脱硝、脱碳和脱硫处理,可达到节能减排、废物利用等目的.
火力发电厂释放出的大量氧化物(NOx)、SO2、CO2会对环境造成污染.对这些废气进行脱硝、脱碳和脱硫处理,可达到节能减排、废物利用等目的.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com