
【题目】著名科学家张青莲教授主持测定了铟、铱、锑、铕等几种元素的相对原子质量新值,其中他测定核电荷数为63的铕元素的相对原子质量的新值为152。则下列说法正确的是( )
A.铕元素的原子质子数为63B.铕元素的原子中子数为63
C.铕元素的原子核外电子数为152D.铕元素的原子的质量为152
科目:高中化学 来源: 题型:
【题目】下列对于“塑料废弃物”的处理方法,最恰当的是( )
A.将废弃物焚烧
B.将废弃物填埋于土壤中
C.将废弃物倾倒在海洋中
D.将废弃物加工成防水材料或汽油,变废为宝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为________。写出SOCl2吸收水蒸气的化学方程式:____________。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):

①装置的连接顺序为A→B→______→______→______→______。
②搅拌的作用是______,冷凝管的作用是______。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg。若![]() _____(保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
_____(保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热即可得到无水ZnCl2,但老师说此方法不可。请用化学方程式解释原因:____________。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。请你设计并简述实验方案判断丁同学的观点:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在0.5L密闭容器中,某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:
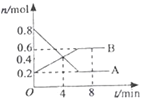
(1)该反应的化学方程式为________________;
(2)若降低温度,则v (正)_____,v (逆)_____;(填“加快”“减慢”或“不变”);
(3)第4min时,正、逆反应速率的大小关系为:v (正)______ v (逆);(填“>”“<”或“=”,下同)
(4)以下措施能加快反应速率的是_________。
A.恒温恒容充入He使压强增大 B.缩小体积,使压强增大
C.恒温恒压充入He D.平衡后加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 硬脂酸甘油酯在NaOH溶液中水解完全后,加入饱和食盐水,下层析出硬脂酸钠
B. 乙酸的分子模型可表示为![]()
C. 石油分馏是物理变化,可得到汽油、煤油和柴油等产品
D. 相同物质的量的C3H6和C3H8O,充分燃烧,消耗氧气量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量评价的主要污染物为PM 10、PM2.5、SO2、NO2、O3、CO等物质。烟气的脱硝(除NOx)
技术和脱硫(除SO2)技术都是环境科学研究的热点,选择性催化还原法(SCR)是目前最成熟的烟气脱硝技术,即在催化剂的作用下,用还原剂选择性地与NOx反应生成N2和H2O。
(1)在催化剂存在的条件下,用H2将NO还原为N2。已知:

则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_____________。
(2)用热炭还原NO的反应为2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为T1℃、T1℃、T2℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为T1℃、T1℃、T2℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 | 200 |
n(NO) /mol(甲容器/T1℃) | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 | 0. 80 |
n(NO) /mol(乙容器/T1℃) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 | 0.40 |
n(NO) /mol(丙容器/T2℃) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 | 1.00 |
①该反应T1_________T2,H________0 (填“<”或“>”)。
②若乙容器在200min达到平衡状态,则0~ 200min内用CO2的浓度变化表示的平均反应速率v(CO2)=____。
(3)用焦炭还原NO2的反应为2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量C发生该反应,测得平衡时NO2CO2的物质的量浓度与平衡总压的关系如图18所示:
N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量C发生该反应,测得平衡时NO2CO2的物质的量浓度与平衡总压的关系如图18所示:

①A、B两点的浓度平衡常数关系:Kc(A)__________ (填“<” 、“>” 或“=”)
②A、B、C三点中NO2的转化率最低的是________(填“A” 、“B” 或“C”)点。
③计算C点时该反应的压强平衡常数Kp(c)=___________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)在催化剂的作用下,尿素可以与NO2反应生成N2、H2O和CO2。写出CO(NH2)2与NO2反应的化学方程式:___________。
(5)氮的化合物应用广泛。氯胺(NH2Cl)是常用的饮用水二级消毒剂,可作长效缓释消毒剂,已知NH2Cl易水解生成强氧化性的物质,写出NH2Cl与水反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.麦芽糖及其水解产物均能发生银镜反应
B.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
C.用溴水即可鉴别苯酚溶液、2,4﹣已二烯和甲苯
D.用甘氨酸(H2N﹣CH2﹣COOH)和丙氨酸( ![]() )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷电路板在科技领域具有不可替代的作用,它的制备方法为高分子化合物和铜箔压合,通过FeCl3溶液“腐蚀”而成。某实验小组在实验室用废弃的印刷电路板和“腐蚀液”提取铜的一种工艺流程如下:
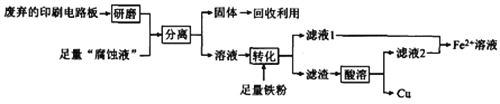
请回答下列问题:
(1)检验“腐蚀液”中含有Fe3+的方法为_____________________________。
(2)“分离”所用的操作名称为________ 。该操作所用的主要玻璃仪器除了有烧杯还有_______。
(3)Fe2+溶液有很多重要用途。
①已知:常温下Ksp[Fe(OH)2]=1.8×10-16。保存1.8mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊,应调节溶液的pH不超过_______________。
②Fe2+转化为Fe3+后,可用于制备高铁酸盐。向FeCl3溶液中加入NaOH、NaClO溶液制备Na2FeO4的化学方程式为____________________________________________。
③一定温度下,向0.1 molL-1的Fe(NO3)2溶液中加入AgNO3 固体忽略溶液体积的变化,平衡c(Fe3+)与c(Ag+)的关系如图所示:Fe2++Ag+![]() Fe3++Ag
Fe3++Ag
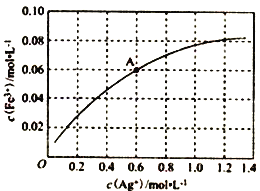
该温度下,A 点溶液中以上反应的化学平衡常数为__________(溶液体积变化忽略不计);若将0.6 molL-1Fe(NO3)2溶液、0.15 molL-1Fe(NO3)3溶液、0.06molL-1AgNO3溶液等体积混合后,再加入1.08gAg,可观察到的现象为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(装置如图),则下列说法正确的是( ) 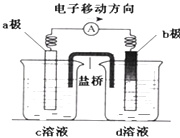
A.d溶液是稀硫酸
B.c溶液颜色变蓝
C.b极发生氧化反应
D.a极是铜棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com