
【题目】将x molA与y mol B充入密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g);ΔH=-akJ·mol-1(a>0)
zC(g);ΔH=-akJ·mol-1(a>0)
在某温度下达到平衡状态,请回答下列问题:
(1)若减压后v正<v逆,则x、y、z的关系是____。
(2)若恒温、恒压下向原平衡中加入C,则平衡_____移动(填“正向”、“逆向”或“不”),重新达平衡后C的体积分数_____(填“增大”、“减小”或“不变”)。
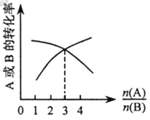
(3)如图,纵坐标为反应物的转化率,横坐标是反应物初始用量之比![]() ,则x∶y =___;
,则x∶y =___;![]() 一定时,平衡状态A的转化率在恒温条件下比在绝热环境中是高还是低?____。
一定时,平衡状态A的转化率在恒温条件下比在绝热环境中是高还是低?____。
(4)恒温、恒容下,x mol A与y mol B反应达到平衡时能量变化为a1 kJ,xmolA与1.5ymolB反应达到平衡时能量变化为a2kJ,则a、a1、a2、由大到小顺序为____。(a、a1、a2均大于0)
【答案】x+y>z 逆向 不变 3∶l 高 a>a2>a1
【解析】
将x molA与y mol B充入密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g);ΔH=-akJ·mol-1(a>0) 在某温度下达到平衡状态,请回答下列问题:
zC(g);ΔH=-akJ·mol-1(a>0) 在某温度下达到平衡状态,请回答下列问题:
(1)减小压强,平衡向气体总物质的量增大的方向移动;
(2)增大反应物的量,平衡逆向移动;在恒温、恒压下向原平衡中加入C,重新形成的平衡与平衡等效;
(3)反应物的起始物质的量之比等于化学计量数之比时,反应物的转化率相等;如图,当![]() =3时,A的转化率和B的转化率相等;
=3时,A的转化率和B的转化率相等;![]() 一定时,温度升高平衡向吸热反应方向移动;
一定时,温度升高平衡向吸热反应方向移动;
(4)可逆反应,反应物的转化率始终小于100%;增大反应物的量,平衡正向移动。
将x molA与y mol B充入密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g);ΔH=-akJ·mol-1(a>0) 在某温度下达到平衡状态,请回答下列问题:
zC(g);ΔH=-akJ·mol-1(a>0) 在某温度下达到平衡状态,请回答下列问题:
(1)减小压强,平衡向气体总物质的量增大的方向移动,若减压后v正<v逆,说明平衡逆向移动,即逆方向是气体总物质的量增大的方向,即x、y、z的关系是x+y>z;
(2)增大反应物的量,平衡逆向移动;则在恒温、恒压下向原平衡中加入C,平衡逆向移动,重新形成的平衡与平衡等效,即C的体积分数不变;
(3)反应物的起始物质的量之比等于化学计量数之比时,反应物的转化率相等;如图,当![]() =3时,A的转化率和B的转化率相等,即x∶y =3:1;已知xA(g)+yB(g)
=3时,A的转化率和B的转化率相等,即x∶y =3:1;已知xA(g)+yB(g)![]() zC(g);ΔH=-akJ·mol-1(a>0),
zC(g);ΔH=-akJ·mol-1(a>0),![]() 一定时,反应在绝热条件下进行,容器内温度升高,相对恒温条件下的平衡状态,平衡逆向移动,则温度升高平衡向吸热反应方向移动,平衡状态A的转化率在恒温条件下比在绝热环境中高;
一定时,反应在绝热条件下进行,容器内温度升高,相对恒温条件下的平衡状态,平衡逆向移动,则温度升高平衡向吸热反应方向移动,平衡状态A的转化率在恒温条件下比在绝热环境中高;
(4)恒温、恒容下,已知xA(g)+yB(g)![]() zC(g);ΔH=-akJ·mol-1(a>0),则当xmol的A完全反应时反应放出的热量为akJ; x mol A与y mol B反应达到平衡时能量变化为a1 kJ, xmolA与1.5ymolB反应达到平衡时A的转化率比x mol A与y mol B反应达到平衡时转化率大,则能量变化为a2kJ>a1kJ,因xmolA不能完全转化,则放出的能量小于akJ;即a>a2>a1。
zC(g);ΔH=-akJ·mol-1(a>0),则当xmol的A完全反应时反应放出的热量为akJ; x mol A与y mol B反应达到平衡时能量变化为a1 kJ, xmolA与1.5ymolB反应达到平衡时A的转化率比x mol A与y mol B反应达到平衡时转化率大,则能量变化为a2kJ>a1kJ,因xmolA不能完全转化,则放出的能量小于akJ;即a>a2>a1。


科目:高中化学 来源: 题型:
【题目】漂白粉在社会生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。洪水过后,灾区人们的饮用水必须用漂白粉等药品消毒后才能饮用,以防传染病发生,但瓶装漂白粉久置空气中会呈稀粥状而失效。
(1)漂白粉可用来漂白或杀菌消毒,用化学方程式表示其原理:________________。
(2)用化学方程式表示漂白粉在空气中易失效的原因:________________________。
(3)已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y和Z为原子序数依次增大的四种短周期主族元素。X在短周期元素中原子半径最大,Y的最高正价与最低负价代数和为0,Z是所在周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如右图所示。下列叙述不正确的是
![]()
A.W和X形成的化合物的水溶液呈碱性
B.气态氢化物稳定性:Z>Y
C.右图化合物中W和Y均满足8电子稳定结构
D.可用pH试纸测定Z单质水溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制1000 mL 2 mol/L NaOH溶液,请回答下列问题:
(1)下面是几种实验中常用的仪器:
A. 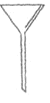 B.
B. ![]() C.
C.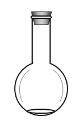 D.
D.![]()
①写出仪器A的名称__________
②配制过程中不需要使用的化学仪器有______(填仪器的字母)。
(2)用托盘天平称取氢氧化钠,其质量为______g。
(3)下列主要操作步骤的正确顺序是_________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到100 mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)下列情况中,会使所配溶液浓度偏高的是___________(填序号)。
A.定容时观察液面俯视 B.没有进行上述的操作步骤⑤
C.称量的氢氧化钠已潮解 D.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备与工业生产相符的是
①NH3![]() NO
NO![]() HNO3
HNO3
②浓HCl![]() Cl2
Cl2 ![]() 漂白粉
漂白粉
③MgCl2(aq)![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
④饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
⑤铝土矿![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() Al
Al
A. ①④⑤ B. ①③⑤ C. ②③④ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1molH—H键断裂的同时断裂2molH—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为VL的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中![]() =____。
=____。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_____。
(3)下列叙述能说明上述反应达到平衡状态的是____(填字母)。
A 反应中M与N的物质的量之比为1∶1
B 混合气体的总质量不随时间的变化而变化
C 混合气体的总物质的量不随时间的变化而变化
D 单位时间内消耗a mol N,同时生成b mol M
E 混合气体的压强不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
A.反应正好达到平衡
B.反应向左进行
C.反应向某方向进行一段时间后K<57.0
D.反应向某方向进行一段时间后c(H2)<0.2mol·L1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com