
| A. | Z为0.3 mol•L-1 | B. | Y2为0.1 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,采取一边倒“一边倒”求出三种物质浓度的极大值、极小值,确定三种物质的浓度的取值范围.
解答 解:假定反应向正反应进行到底,则:
2X2(g)+Y2(g)?2Z(g),
开始(mol/L):0.1 0.2 0.2
变化(mol/L):0.1 0.05 0.1
平衡(mol/L):0.05 0.15 0.3
假定反应向逆反应进行到底,则:
2X2(g)+Y2(g)?2Z(g),
开始(mol/L):0.1 0.2 0.2
变化(mol/L):0.2 0.1 0.2
平衡(mol/L):0.3 0.3 0
因此0.05mol•L-1<c(X2)<0.3mol•L-1,0.15mol•L-1<c(Y2)<0.3mol•L-1,0<c(Z)<0.3mol•L-1,
A.0<c(Z)<0.3mol•L-1,故A错误;
B.0.15mol•L-1<c(Y2)<0.3mol•L-1,故B错误;
C.0.05mol•L-1<c(X2)<0.3mol•L-1,故C正确;
D.0<c(Z)<0.3mol•L-1,故D错误;
故选C.
点评 本题考查化学平衡的可逆性,关键是利用可逆反应的不完全性,运用极限假设法解答,难度不大.


科目:高中化学 来源: 题型:解答题
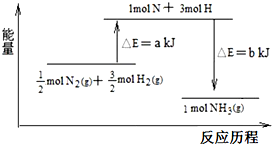
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氯化氧(OCl2) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 六氟化氙(XeF6) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,100mLPH=1的CH3COOH溶液中含有的H+总数大于0.01NA | |
| B. | 标准状况下,11g3H216O种含有的质子数为6NA | |
| C. | 1molLi2O和Na2O2的混合物中含有的离子总数为3NA | |
| D. | 1molN2与足量H2混合,充分反映后转移电子数为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com