
【题目】下列说法正确的是( )
A.1mol化合物 ![]() 分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等
分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等
B.等质量的乙醇、乙烯、甲烷分别充分燃烧,所耗用氧气的量依次减少
C.聚乳酸( ![]() )是由单体之间通过加聚反应合成的
)是由单体之间通过加聚反应合成的
D.实验证实 ![]() 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
【答案】D
【解析】解:A.有机物中含有酚羟基,邻位的2个H原子可发生取代反应,含有C=C,可与溴发生加成反应,则1mol陈皮跟浓溴水反应消耗3mol溴;酚羟基具有酸性,可与NaOH反应,酯基水解生成酚羟基和羧基,则与NaOH反应,酚羟基具有酸性,可与NaOH反应,则1mol陈皮消耗4molNaOH,故A错误;
B.含氢量越高耗氧量越高,等质量时甲烷耗氧量最大,故B错误;
C.聚乳酸( ![]() )是由单体之间通过加聚反应合成的,故C错误;
)是由单体之间通过加聚反应合成的,故C错误;
D.含有碳碳双键,可与溴水发生加成反应,可用于证明,故D正确.
故选D.
【考点精析】根据题目的已知条件,利用有机物的结构和性质的相关知识可以得到问题的答案,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.


科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。某学生为了探究镁条与盐酸反应过程中反应速率的变化,利用如图装置测定一定时间内反应放出氢气的体积(加入稀盐酸的体积为100mL.忽略反应中溶液体积的变化),实验记录如下表(累计值):
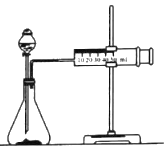
时间(min) | l | 2 | 3 | 4 | 5 | 6 |
氢气体积(mL)(标准状况) | 1 | 50 | 120 | 232 | 288 | 310 |
(1)除如图所示的实验用品外,还需要的一件实验仪器是_________。
(2)实验前,检查该装置气密性的方法是_________。
(3)装置气密性良好,0~lmin时间段氢气体积却很少的原因是_________。
(4)反应速率最大的时间段是_________min(填“0~1”1~2”2~3”3~4”“4~5”或“5~6”),原因是_________(从影响反应速率因素的角度解释)。
(5)3~4min时间段,以盐酸的浓度变化来表示的该反应速率为_________(设溶液体积不变)。
(6)由于反应太快,测量氢气体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列液体以减慢反应速率,你认为不可行的是_________(填相应字母)。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,对于相同质量的O2和O3,下列说法正确的是( )
A.原子数之比为1:1B.分子数之比为1:1
C.密度之比为1:1D.体积之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3 . 其中HNO3为反应物,则该反应中的还原剂为( )
A.NO
B.BFeSO4
C.Fe(NO3)3
D.Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们日常生活中出现了“加碘食盐”、“增铁酱油”、“富硒茶叶”和“含氟牙膏”等商品。这里的碘、铁、硒、氟应理解为( )
A.元素B.单质C.分子D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺的电离方程式为: NH2OH+H2O ![]() NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
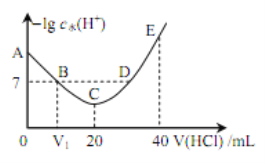
A. 图中 V1>10
B. A 点对应溶液的 pH=9.5
C. B、 D 两点对应的溶液均为中性
D. E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属硼的合金及其化合物有着广泛的用途。
(1)硼钢合金的硬度是普通钢材的 4 倍,其主要成分是铁。 画出基态铁原子的价电子排布图_____。
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键, 则氨硼烷分子结构式为_____。写出一种与氨硼烷互为等电子体的分子_____(填化学式)。
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如右图所示。
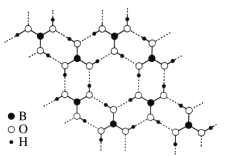
①1 mol H3BO3晶体中含有______mol 氢键。
②请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:__________。
(4)硼氢化钠是一种常用的还原剂。其晶胞结构如右图所示:

①该晶体中Na+的配位数为_____。
②H3BO3 分子中的 O—B—O 的键角_____(填“大于”、“等于”或“小于”) BH4-中的 H—B—H 的键角,判断依据是_____。
③已知硼氢化钠晶体的密度为 ρ g/cm3, NA代表阿伏伽德罗常数的值,则 a=_____(用含 ρ、 NA的代数式表示);④若硼氢化钠晶胞上下底心处的 Na+被 Li+取代,得到的晶体的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、Na、S是常见的六种元素。请回答下列问题。
(1)S在元素周期表中的位置为______________。
(2)上述元素中非金属性最强的是______________(填元素符号)。
(3)下列事实能说明O的非金属性比S的非金属性强的是________(填字母代号)。
a.O2与H2S溶液反应,溶液变浑浊
b.加热条件下H2S比H2O更容易分解
c.在氧化还原反应中,1 mol O2比1 mol S得电子多
d.H2O的沸点比H2S高
(4)一定条件下,Na还原CCl4可得到金刚石与一种可溶性盐,该反应的化学方程式为_________________。
(5)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。
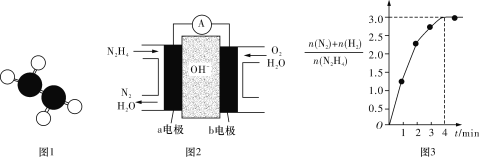
①已知肼的球棍模型如图1所示,试写出肼的电子式:______________。
②目前正在研发的一种肼燃料电池的结构如图2所示,________(填“a”或“b”)电极为电池的负极。
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应N2H4(l) ![]() N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=____________。
N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com