
【题目】下列实验操作或对实验事实的叙述正确的是
①用稀盐酸洗涤盛放过石灰水的试剂瓶;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③有六种分别含Na+、Mg2+、Al3+、Fe2+、Fe3+、NH4+阳离子的溶液,不能用NaOH溶液鉴别;
④用稀硝酸清洗做过银镜反应实验的试管;
⑤如果皮肤上不慎沾有苯酚,应立即用大量的NaOH稀溶液冲洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧向某溶液加入NaOH浓溶液并加热能产生能使湿润的红色石蕊试纸变蓝的气体则原溶液中含NH4+
A. ①⑤⑦ B. ③④⑦⑧ C. ①②④⑧ D. ②③⑤⑥
【答案】C
【解析】①.石灰水是Ca(OH)2溶液,它与空气中的CO2发生反应生成白色碳酸钙沉淀,碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,故①正确;
②.浓硫酸稀释时放热,所以配制浓硫酸和浓硝酸的混合溶液时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌,故②正确;
③.六种分别含Na+、Mg2+、Al3+、Fe2+、Fe3+、NH4+阳离子的溶液,分别加入过量的NaOH溶液,含Na+的溶液无明显现象,含Mg2+的溶液生成白色沉淀,含Al3+的溶液先生成白色沉淀,后白色沉淀又完全溶解,含Fe2+的溶液先生成白色沉淀,迅速变成灰绿色,最终变成红褐色,含Fe3+的溶液生成红褐色沉淀,含NH4+的溶液加入NaOH溶液后加热,产生使湿润红色石蕊试纸变蓝的气体,现象各不相同,所以可以用NaOH溶液检验,故③错误;
④.做过银镜反应实验的试管内壁残留的有单质银,加入稀硝酸可以和银反应使银溶解,故④正确;
⑤.氢氧化钠具有强烈的腐蚀性,所以不能用大量的NaOH稀溶液冲洗,故⑤错误;
⑥.瓷坩埚的成分里含有SiO2,在高温下会和碳酸钠反应:Na2CO3+SiO2![]() Na2SiO3+CO2↑,会腐蚀瓷坩埚,所以不能用瓷坩埚,应用铁坩埚,故⑥错误;
Na2SiO3+CO2↑,会腐蚀瓷坩埚,所以不能用瓷坩埚,应用铁坩埚,故⑥错误;
⑦.实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时停止加热,而不是向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,故⑦错误;
⑧.氨气溶于水显碱性能使湿润红色石蕊试纸变蓝,所以某溶液加入NaOH并加热能产生使湿润红色石蕊试纸变蓝的气体,该气体是氨气,故原溶液中含NH4+,故⑧正确;
故答案选C。


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】实验室制取乙炔的实验装置图(如图)中,
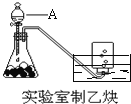
(1)A仪器的名称为_________________;所盛的试剂为_________________;发生反应的化学方程式为:__________________________________________________;
(2)将反应产生的乙炔通入酸性高锰酸钾溶液中,观察到的现象是:_________________;将反应产生的乙炔通入溴的四氯化碳溶液中,反应的化学方程式为:__________________________________;(产物为1,2-二溴乙烯)
(3)生成的乙炔中可能含有的杂质气体是_________________,除去的方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

(1)A是铅蓄电池的________极,铅蓄电池正极反应式为_________________,放电过程中电解液的密度________(填“减小”“增大”或“不变”)。
(2)Ag电极的电极反应式是________,该电极的电极产物共________g。
(3)Cu电极的电极反应式是________________________________________,
CuSO4溶液的浓度________(填“减小”、“增大”或“不变”)。
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示________。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu + H2O |
方法d | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-157kJ·mol-1
则方法a发生的热化学方程式是:________________________。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:
该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:_____________ 钛极附近的pH值________ (增大、减小、不变)。

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为:____________。
(4)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O![]() 2H2+O2 ΔH>0
2H2+O2 ΔH>0
水蒸气的浓度随时间t变化如下表所示。
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.0500 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.1000 | 0.0940 | 0.0900 | 0.0900 | 0.0900 | 0.0900 |
①对比实验的温度T2_____ T1(填“>”“<”或“=”)。
②实验①前20 min的平均反应速率v(O2)=______。
③催化剂催化效率:实验①______实验② (填“>”、“<")。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___________________________。
(2)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ ______________。过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_________(填“偏高”、“偏低”或“无影响”)。
[方案二]
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01![]() 105Pa)的体积。
105Pa)的体积。
〖问题讨论〗(3)同学们拟选用图一实验装置完成实验:

①你认为最简易的装置其连接顺序是:A接(____)(_____)接(____)( )接( )(填接口字母,可不填满。)②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因_________________________。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的是__________。(有几个选几个)。
A.等待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平,读取量筒中水的体积
(4)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图二的实验装置。

①装置中导管a的作用是_________________________。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。(用含V1、V2的式子表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现生物体内有七十多种酶的活性与Zn2+有关,这说明无机盐( )
A. 对维持酸碱平衡有重要作用
B. 对维持细胞形态有重要作用
C. 对维持生物体的生命活动有重要作用
D. 对调节细胞内溶液的浓度有重要作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是____。
(2)在操作正确的前提下,提高中和热制定准确性的关键是____.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=____[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g.℃)计算].
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_____(填“偏大”、“偏小”、“不变”).如改用60 mL0.5moI/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热_____(填“相等”或“不相等”)。
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是______________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:

(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥_______。
(2)试验编号②和③探究的内容是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com